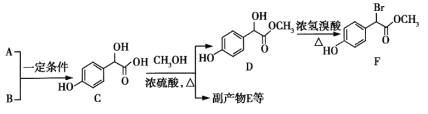
题目内容
【题目】已知A、B、C、D、E是短周期中的5种非金属元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族;E元素原子L层电子数是K层和M层电子数之和。
(1)写出元素符号:A______ , B______ ,C______ ,D______ ,E__________。
(2)画出E的阴离子的结构示意图:_____________;
(3)A单质和C单质在一定条件下反应生成化合物X,该反应的化学方程式为_______________。向X的水溶液中滴入酚酞溶液,会观察到________________________________________。
(4)将9g B单质在足量的D单质中燃烧,所得气体通入1L 1moL-1 NaOH溶液中,完全吸收后,溶液中大量存在的离子是_______________。
【答案】H C N O S 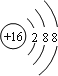 N2+3H2
N2+3H2![]() 2NH3 溶液变红 Na+ 、CO32-、HCO3-
2NH3 溶液变红 Na+ 、CO32-、HCO3-
【解析】
A、B、C、D、E是短周期中的5种非金属元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零,则A为H元素;B原子的最外层电子数是内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;E元素与D元素同主族;E元素原子L层电子数是K层和M层电子数之和。E为S元素,则D为O元素;C、D在元素周期表中处于相邻的位置,且D的原子序数大,则C为N元素,然后分析。
(1)由上述分析可知,A为H元素、B为C元素、C为N元素、D为O元素,E为S元素, A、B、C、D、E、分别是H;C;N;O;S;
(2)E的阴离子为S2-,离子结构示意图: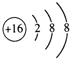 ;
;
(3)A的单质是氢气,C的单质是氮气,氢气和氮气在一定条件下反应生成氨气,N2+3H2![]() 2NH3,在氨水中存在NH3+H2O=NH3·H2O,NH3·H2O
2NH3,在氨水中存在NH3+H2O=NH3·H2O,NH3·H2O ![]() NH4++OH-,因此 氨气的水溶液呈碱性,滴入酚酞溶液,溶液呈红色;
NH4++OH-,因此 氨气的水溶液呈碱性,滴入酚酞溶液,溶液呈红色;
(4)9gC的物质的量是0.75mol,C在足量的氧气中燃烧,所得气体是CO2,C+O2 ![]() CO2,所以生成的二氧化碳是0.75mol,NaOH的物质的量为n=1L×1mol/L=1mol,二氧化碳与氢氧化钠的物质的量之比为3:4,由CO2+NaOH=NaHCO3 ,CO2+2NaOH=Na2CO3+H2O可知,当二氧化碳与氢氧化钠的物质的量比为1:1时,产物是碳酸氢钠;当二氧化碳与氢氧化钠的物质的量比为1:2时,产物是碳酸钠;当二氧化碳与与氢氧化钠的物质的量之比大于
CO2,所以生成的二氧化碳是0.75mol,NaOH的物质的量为n=1L×1mol/L=1mol,二氧化碳与氢氧化钠的物质的量之比为3:4,由CO2+NaOH=NaHCO3 ,CO2+2NaOH=Na2CO3+H2O可知,当二氧化碳与氢氧化钠的物质的量比为1:1时,产物是碳酸氢钠;当二氧化碳与氢氧化钠的物质的量比为1:2时,产物是碳酸钠;当二氧化碳与与氢氧化钠的物质的量之比大于![]() 小于1时,产物是碳酸钠和碳酸氢钠的混合物,所以,溶液中的溶质是碳酸钠和碳酸氢钠,故答案为CO32-、HCO3-、Na+。
小于1时,产物是碳酸钠和碳酸氢钠的混合物,所以,溶液中的溶质是碳酸钠和碳酸氢钠,故答案为CO32-、HCO3-、Na+。

 阅读快车系列答案
阅读快车系列答案