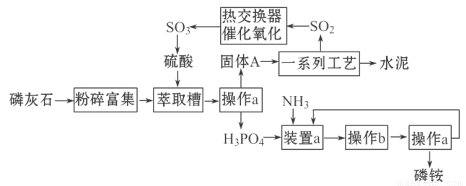
题目内容
硫代硫酸钠的纯度可用滴定法进行测定,原理是:2S2O32-+ I2 → S4O62-+ 2I-
38. 配制100 mL0.0500 mol/L I2溶液,不需要的仪器是 (选填编号)。
a.100 mL容量瓶 b.量筒 c.烧杯 d.玻璃棒
滴定管标有使用温度:20oC; 滴定管的最小刻度为 mL。
39.取2 .500g含杂质的Na2S2O3·5H2O晶体配成50mL溶液,每次取10.00mL放入锥形瓶里,加2滴淀粉为指示剂,再用0.0500 mol/L I2溶液滴定,实验数据如下(第3次初读数为 0.00,终点读数如图; 杂质不参加反应):

编号 | 1 | 2 | 3 |
消耗I2溶液的体积/mL | 19.98 | 20.02 |
|
到达滴定终点的现象是 ;
Na2S2O3?5H2O(式量248)的质量分数是(保留4位小数) 。
40.会造成实验结果偏低的操作是 (选填编号)。
a. 滴定时滴定管中的液体滴在锥形瓶外
b. 锥形瓶用蒸馏水洗净后,立即装入待测溶液
c. 未用标准液润洗滴定管
d. 振荡时溶液溅出锥形瓶外
38.b(1分);0.1(1分).
39.溶液由无色变为蓝色,且半分钟内不褪去(1分,不答全不给分);0.9920或99.20%(1分).
40.d(1分)
【解析】
试题分析:38. 配制100 mL0.0500 mol/L I2溶液,I2需要称量,不需要的仪器是量筒。滴定管的最小刻度为0.1mL。
39.指示剂为淀粉,遇I2变蓝,故到达滴定终点的现象是溶液由无色变为蓝色,且半分钟内不褪去。
取2 .500g含杂质的Na2S2O3·5H2O晶体配成50mL溶液,每次取10.00mL放入锥形瓶里,样品为0.500g;第3次多数为20.10mL,数值与前两次相差较大,舍去。
由2S2O32-+ I2 → S4O62-+ 2I-
n(Na2S2O3·5H2O)=2n(I2)=2×0.0500 mol/L× ×10-3L=0.002mol
×10-3L=0.002mol
故ω(Na2S2O3·5H2O)=  ×100%=99.2%。
×100%=99.2%。
40.a.滴定时滴定管中的液体滴在锥形瓶外,滴定读数偏大,实验结果高;b.锥形瓶用蒸馏水洗净后,立即装入待测溶液,Na2S2O3的计量不变,实验无误差;c.未用标准液润洗滴定管,因滴定管内壁附有水,加入的标准液被稀释,故滴定需要的体积偏大,实验结果高;d.振荡时溶液溅出锥形瓶外,Na2S2O3被损失,滴定需要的标准液体积偏小,实验结果低。
考点:滴定实验原理应用与计算。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是
| 已知 | 类推 |
A. | 将Fe加入CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
B. | 向稀硫酸中加入NaOH溶液至中性 H++OH-=H2O | 向H2SO4溶液中加入Ba(OH)2溶液至中性 H++OH-=H2O |
C. | 向氯化铝溶液中加入足量NaOH溶液 Al3+ + 4OH- = AlO2- + 2H2O | 向氯化铝溶液中加入足量氨水 Al3+ + 4NH3·H2O = AlO2- + 2H2O +4NH4+ |
D. | 向Ca(OH)2溶液中通入过量CO2 CO2 + OH- = HCO3- | 向Ca(OH)2溶液中通入过量SO2 SO2 + OH- = HSO3- |