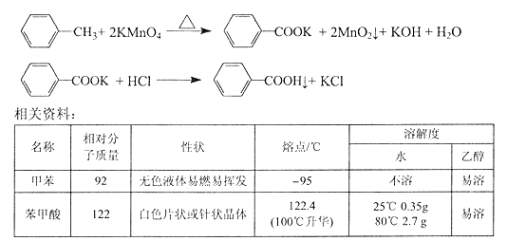
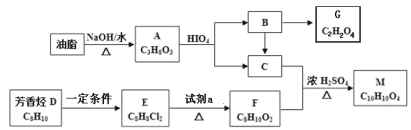
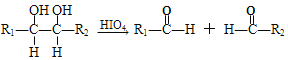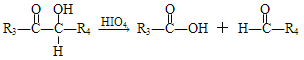题目内容
【题目】工业上采用氨的催化氧化制备硝酸,起反应如下:
![]()
![]()
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80
(1)为使NH3恰好完全氧化为NO,氨-空气混合物中氨的体积分数为 (用小数表示,保留2位小数)
(2)1mol NH3完全转化HNO3,若在此过程中不补充水,则所得HNO3溶液的质量分数为 (用小数表示,保留2位小数)
(3)已知NH3完全转化NO的转化率为95%,由NO转化HNO3的转化率为92%.请计算用17吨NH3可制取质量分数为0.63的硝酸溶液为 吨
(4)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
![]() ①
①
![]() ②
②
若每生产1mol CO2,吸收溶液质量就增加40g。计算吸收液中NaNO2和NaNO3物质的量之比为 。
【答案】(1)0.14;
(2) 0.78;
(3)87.4;
(4)3:1
【解析】
试题分析:(1)氨气恰好完全氧化为一氧化氮,发生反应4NH3+5O2→4NO+6H2O,氨气和氧气物质的量之比为4:5,即氨气和空气物质的量之比为4:(5÷0.2)=4:25,所以氨气所占体积分数即物质的量分数为![]() =0.14,故答案为:0.14;
=0.14,故答案为:0.14;
(2)由方程式可得反应总方程式:NH3+2O2=HNO3+H2O,为使1mol氨气恰好完全转化化为硝酸,所得硝酸溶液中HNO3与H2O的物质的量之比为1:1,故所得硝酸溶液质量分数=![]() ×100%=77.8%,故答案为:77.8%;
×100%=77.8%,故答案为:77.8%;
(3)设用17吨NH3可制取质量分数为0.63的硝酸溶液质量是xmol,则:
NH3~~~~~~HNO3,
17 63
17t×95%×92% 0.63x
解得x=87.4t,
答:用17吨NH3可制取质量分数为0.63的硝酸溶液87.4吨;
(4)反应2NO2+Na2CO3=NaNO2+NaNO3+CO2↑,产生22.4L(标准状况下)CO2时,溶液质量增重△m=48g,反应NO+NO2+Na2CO3=2NaNO2+CO2↑,产生22.4L(标准状况下)CO2时,溶液质量增重△m=32g,实际溶液质量增重40g,上述两个反应都发生,设由NO2与纯碱反应产生的CO2为amol,由NO和NO2与纯碱反应产生的CO2为bmol,则:a+b=1,48a+32b=40,解得a=b=0.5,所以n(NaNO2):n(NaNO3)=(a+2b):a=1.5:0.5=3:1,答:吸收液中NaNO2和NaNO3物质的量之比是3:1.