题目内容
(1)在25℃时,向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子 方程式为_____________________。
方程式为_____________________。
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,
Ksp[Al(OH)3]=3×10-34。)
(2)某温度(t℃)时,测得0.01 mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb=________。
(3)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=________。
(4)(2013·山东高考)25℃时,H2SO3HSO +H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中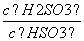 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
解析:(1)根据溶度积常数表达式可知,生成Mg(OH)2沉淀时需要的OH-浓度是 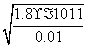 =4.2×10-5mol/L;同样可知生成氢氧化铝沉
=4.2×10-5mol/L;同样可知生成氢氧化铝沉 淀时需要的OH-浓度是
淀时需要的OH-浓度是 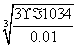 =3.1×10-11mol/L,所以首先生成的是氢氧化铝沉淀,反应的离子方程式是Al3++3NH3·H2O===Al(OH)3↓ +3NH
=3.1×10-11mol/L,所以首先生成的是氢氧化铝沉淀,反应的离子方程式是Al3++3NH3·H2O===Al(OH)3↓ +3NH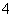 。
。
(2)0.01 mol·L-1的NaOH溶液的pH=11,所以溶液中氢离子浓度是1×10-11mol/L,而OH-浓度是0.01 mol/L,则该温度下水的离子积常数KW=10-13。pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VaL混合,若所得混合液为中性,则Va×0.01=Vb×0.2,所以Va∶Vb=10∶1。
(3)c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积 混合后溶液刚好呈中性,根据电荷守恒可知c(Na+)=c(CH3COO-)=0.01 mol/L,而溶液中氢离子浓度是1×10-7mol/L,根据物料守恒可知,溶液中醋酸的浓度是0.5 c-0.01,该温度下醋酸的电离常数 Ka=
混合后溶液刚好呈中性,根据电荷守恒可知c(Na+)=c(CH3COO-)=0.01 mol/L,而溶液中氢离子浓度是1×10-7mol/L,根据物料守恒可知,溶液中醋酸的浓度是0.5 c-0.01,该温度下醋酸的电离常数 Ka=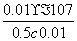 =2×10-9/(c-0.02)。
=2×10-9/(c-0.02)。
(4)Ka=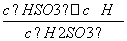 ,HSO
,HSO +H2OH2SO3+OH-,Kb=
+H2OH2SO3+OH-,Kb= =
=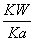 =
=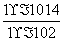 =1.0×10-12,当加入少量I2时,溶液酸性增强,c(H+)增大,但是温度不变,Kb不变,则
=1.0×10-12,当加入少量I2时,溶液酸性增强,c(H+)增大,但是温度不变,Kb不变,则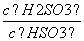 增大。
增大。
答案:(1)Al(OH)3 Al3++3NH3·H2O===Al(OH)3↓+3NH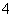 (2)10∶1
(2)10∶1
(3)2×10-9/(c-0.02) (4)1.0×10-12 增大

为了提纯下表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是
( )
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | CH3CH2OH (CH3COOH) | CaO | 蒸馏 |
| D | CO2(SO2) | Na2CO3溶液 | 洗气 |
 下图,回答下列问题:
下图,回答下列问题:
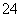 、Na+
、Na+