题目内容
(6分)超氧化物歧化酶SOD(本题用E为代号)是生命体中的“清道夫”,在它的催化作用下生命体代谢过程产生的超氧离子才不致过多积存而使人体过早衰老:
1.超氧离子在催化剂SOD存在下发生如下反应,请完成该反应的离子方程式:
O2-+ ![]() O2+ H2O2
O2+ H2O2
2.今在SOD的浓度为co(E)=0.400×10-6mol?L-1,pH=9.1的缓冲溶液中进行动力学研究,在常温下测得不同超氧离子的初始浓度co(O2-)下超氧化物歧化反应的初始反应速率vo如下表:
co(O2-)/mol?L1 | 7.69×10- | 3.33×10-5 | 2.00×10-4 |
vo/mol?L-1?s-1 | 3.85×10-3 | 1.67×10-2 | 0.100 |
已知该歧化反应在常温下的速率方程可表示为:v0=kcon,其中n为该反应的反应级数,k为速率常数。试根据测定数据确定该歧化反应的反应级数n和速率常数k。要求计算过程。
1.2O2-+2H+![]() O2+H2O2(1分)
O2+H2O2(1分)
2.首先根据题给v和c(O2-)的数据确定反应级数和速率常数k
v1/v2={c1(O2)/c2(O2)}n,3.85×10-3/1.67×10-2=(7.69×10-6/3.33×10-5)n,n=1
v2/v3={c2(O2)/c3(O2)}n,1.67×10-2/0.100=(3.33×10-5/2.000×10-4)n,n=1
v=kc(O2-) (2分) 即
k=v1/c(O2-)1=3.85×10-5/7.69×10-6=501s-1
k=v2/c(O2-)2=1.67×10-2/3.33×10-5=502s-1
k=v3/c(O2-)3=0.1/2.00×10-4=500s-1
平均k=501s-1(3分)

超氧化物歧化酶SOD(本题用E为代号)是生命体中的“清道夫”,在它的催化作用下生命体代谢过程产生的超氧离子才不致过多积存而毒害细胞:
![]()
今在SOD的浓度为co(E) = 0.400X10-6 mol?L1,pH=9.1的缓冲溶液中进行动力学研究,在常温下测得不同超氧离子的初始浓度co(O2)下超氧化物歧化反应的初始反应速率ro如下:
co(O2)/mol?L1 | 7.69 X 106 | 3.33 X 105 | 2.00 X 104 |
ro/mol?L1?s1 | 3.85 X 103 | 1.67 X 102 | 0.100 |
3-1 依据测定数据确定歧化反应在常温下的速率方程r = k c(O2)n的反应级数。
3-2 计算歧化反应的速率常数k。要求计算过程。
3-3 在确定了上述反应的级数的基础上,有人提出了歧化反应的机理如下:
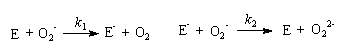
其中E为中间物,可视为自由基;过氧离子的质子化是速率极快的反应,可以不予讨论。试由上述反应机理推导出实验得到的速率方程,请明确指出推导过程所作的假设。
3-4 设k2 = 2k1,计算k1和k2。要求计算过程。