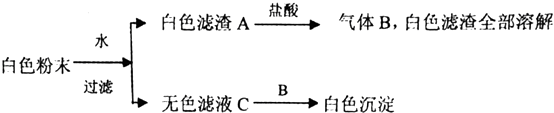
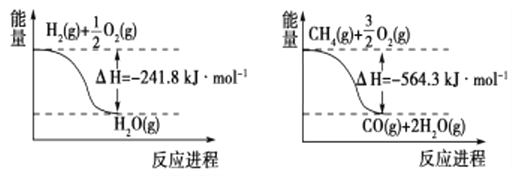
题目内容
【题目】下列说法错误的是( )
A. 从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B. 不同非金属元素原子之间形成的化学键都是极性键
C. 水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键
D. 某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE
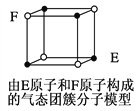
【答案】D
【解析】A.由价层电子对互斥理论计算分析,CH4、NH4+、SO42-、PH4+、PO43-都采取sp3杂化且为四配位,所以这些微粒都正四面体结构,A正确;B. 不同非金属元素的电负性不同,共用电子对受非金属元素原子的吸引力不同,它们之间形成的化学键都是极性键,B正确;C. 水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键,C正确;D. 某气态团簇分子结构如图所示,每个原子都属于这个分子所有,则该气态团簇分子的分子式为E4F4或F4E4,D错误。

 阅读快车系列答案
阅读快车系列答案【题目】下表是元素周期表的一部分,根据表中给出的①—⑥六种元素,回答下列问题:
族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ |
(1)画出元素④的原子结构示意图__________;
(2)元素①形成的最简单有机物的化学式是__________;
(3)表中所列元素中非金属性最强的元素是__________(填元素符号)
(4)元素⑤形成的最高价氧化物对应的水化物的化学式是__________;
(5)元素③和元素⑥形成的化合物的电子式是__________。
【题目】等电子体的结构相似、物理性质相近,称为等电子原理。如N2和CO为等电子体。下表为部分元素等电子体分类、空间构型表。
等电子体类型 | 代表物质 | 空间构型 |
四原子24电子等电子体 | SO3 | 平面三角形 |
四原子26电子等电子体 | SO32- | 三角锥形 |
五原子32电子等电子体 | CCl4 | 四面体形 |
六原子40电子等电子体 | PCl5 | 三角双锥形 |
七原子48电子等电子体 | SF6 | 八面体形 |
由第一、二周期元素组成,与F2互为等电子体的离子有__________。