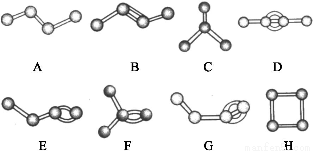
题目内容
下列各反应属于加成反应的是( )。
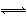
A.CH4+2O2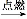 CO2+2H2O
CO2+2H2O
B.CH2 CH2+Br2
CH2+Br2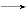 CH2Br—CH2Br
CH2Br—CH2Br
C.CH4+Cl2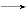 CH3Cl+HCl
CH3Cl+HCl
D.2CH3CH2OH+O2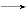 2CH3CHO+2H2O
2CH3CHO+2H2O
B
【解析】A是氧化反应,C是取代反应,D是氧化反应。

 名校课堂系列答案
名校课堂系列答案)实验室制备硝基苯的方法是将苯与浓硫酸和浓硝酸的混合液加热到55~60 ℃反应,已知苯与硝基苯的基本物理性质如下表所示:
| 熔点 | 沸点 | 状态 |
苯 | 5.51 ℃ | 80.1 ℃ | 液体 |
硝基苯 | 5.7 ℃ | 210.9 ℃ | 液体 |
(1)要配制浓硫酸和浓硝酸的混合酸的注意事项是_________。
(2)分离硝基苯和水的混合物的方法是________;分离硝基苯和苯的方法是__________________________。
(3)某同学用如图装置制取硝基苯:
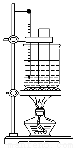
①用水浴加热的优点是_____________________;
②指出该装置的两处缺陷___________________;___________。
某同学为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折算为标准状况),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、、4~5 min)反应速率最大 _______,原因是 _________________________。
(2)哪一时间段的反应速率最小 ,原因是 _________________________
(3)求2~3 min时间段以盐酸的浓度变化来表示的该反应速率 ________________
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水B.NaCl溶液C.Na2CO3溶液D.CuSO4溶液
你认为可行的是(填编号) 。