题目内容
在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是( )
A. 将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多
B. 盐酸和醋酸都可用相应的钠盐与浓硫酸反应制取
C. 相同pH值的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH值变化大
D. 相同pH值的盐酸和醋酸分别跟锌反应时,产生氢气的起始速度相等
【答案】
AC
【解析】试题分析:A项对于强酸来说,每稀释10倍PH值会增大1,醋酸的PH值要想增大1,如果是强酸,和盐酸一样的水,但是醋酸要的水多,说明它是弱酸,PH变化更慢;B项仅仅说明了盐酸和醋酸都可以用浓硫酸的强酸制取盐酸、醋酸,以强制弱;C项醋酸的溶液中存在着CH3COOH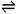 CH3COO—+H+的电离平衡,CH3COONa溶于水后,电离出大量CH3COO-离子,使醋酸的电离平衡向生成醋酸的方向移动,抑制了CH3COOH的电离,使c(H+)减小,因此溶液的pH增大。由此证明盐酸为强酸,醋酸为弱酸。D项在反应开始时,c(H+)相同,所以反应速率就相等,不能说明醋酸是弱酸;故选AC。
CH3COO—+H+的电离平衡,CH3COONa溶于水后,电离出大量CH3COO-离子,使醋酸的电离平衡向生成醋酸的方向移动,抑制了CH3COOH的电离,使c(H+)减小,因此溶液的pH增大。由此证明盐酸为强酸,醋酸为弱酸。D项在反应开始时,c(H+)相同,所以反应速率就相等,不能说明醋酸是弱酸;故选AC。
考点:考察弱电解质电离的不同特点和平衡的移动。
点评:能够判断是弱酸的方法有几种:(1)稀释10倍后PH变化;(2)PH相同的酸与活泼金属反应,弱酸生成的气体多;(3)生成的盐显碱性则是弱酸。除此之外,还要看题目给的类型,具体问题,根据平衡移动来判断。

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目