��Ŀ����
����Ŀ��
�״�������������ϸ���У���ά�ֹ��������ݵı�Ҫ���ʣ������������������ϵĻ�ѧ��Ӧ���ش��������⣺
��1����̬Pԭ�ӵĺ�������Ų�ʽΪ__________����______��δ�ɶԵ��ӡ�д������ͬ��������Ԫ�ص�һ�����ܵĴ�С˳��_________��
��2����һ��ͬ�������塪�����ף�P4���������Ϊ_________���Ʋ�����CS2�е��ܽ��___________������ڡ���С�ڡ�����ˮ�е��ܽ��
��3��������������̬�⻯��좣�PH3���͵���NH3���ļ��Ƿֱ�Ϊ93.6���107�㣬�Է���PH3���ļ���С��NH3��ԭ��_________��д��һ���뻥Ϊ�ȵ������������_________��
��4��PCl3����ԭ���ӻ��������Ϊ________��VSEPR ģ��Ϊ_______��
��5������BP����һ�ֳ�Ӳ��ĥͿ����ϣ���ͼΪ�������徧�������е�ÿ��ԭ�Ӿ�����8�����ȶ��ṹ�����ж����۵�______������ڡ����ڡ������ʯ�۵㡣
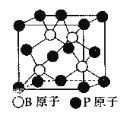
��֪��B-P������Ϊx cm�������ܶ�Ϊ_____g/cm3���г�����ʽ���ɣ�
���𰸡� 1s22p63s23p3 3 P>S>Si��Si>S>P 60�� ���� �縺��Nǿ��P������ԭ�ӵĵ縺��Խ�ɼ��ĵ��Ӷ�������ԭ��Խ�����ɼ����Ӷ�֮�����ԽС���ɼ����Ӷ�֮����ų��������DZ�� H3O+ sp3�ӻ� �������ͣ����������Ͳ����֣� ���� ![]() ��
��
��������(1)Pԭ�ӵĺ˵����Ϊ15�����̬Pԭ�ӵĺ�������Ų�ʽΪ1s22p63s23p3 ��p�������3��δ�ɶԵ��ӣ�ͬ��������Ԫ�صĵ�һ����ͨ����˵���������������ƣ���P��p���Ϊ������ṹ������ȶ�����һ�����ܽϴ���Si��P��S��һ�����ܵĴ�С˳��P>S>Si��
(2)����(P4)����������ṹ��6��P��P����������ȣ��������Ϊ60����P4�Ǻ��зǼ��Լ��ķǼ��Է��ӣ�������������ԭ�����Ʋ����ڷǼ����ܼ�CS2�е��ܽ�ȴ��ڼ����ܼ�ˮ�е��ܽ�ȣ�
(3)��N�ķǽ����Ա�Pǿ����縺��Nǿ��P������ԭ�ӵĵ縺��Խ�ɼ��ĵ��Ӷ�������ԭ��Խ�����ɼ����Ӷ�֮�����ԽС���ɼ����Ӷ�֮����ų��������DZ��PH3�ļ���С��NH3����NH3���ӻ�Ϊ�ȵ������һ������������Ӧ������ͬ�ļ۵�����8��ԭ����4������ΪH3O+��
(4)PCl3��Pԭ�ӵļ۵��Ӷ���3���¶Ե�����Ϊ![]() =1����Pԭ�ӵ��ӻ��������Ϊ sp3�ӻ���VSEPR ģ��Ϊ�������ͣ�
=1����Pԭ�ӵ��ӻ��������Ϊ sp3�ӻ���VSEPR ģ��Ϊ�������ͣ�
(5)�����У�Pλ�ڶ�������ģ���ĿΪ8��![]() +6��
+6��![]() =4��Bλ�ھ����ڣ���ĿΪ4����������Ļ�ѧʽΪBP������������һ�ֳ�Ӳ��ĥͿ����ϣ�����ԭ�Ӿ��壬��C��ԭ�Ӱ뾶��B��P��С����C��C�ļ�����B��P�����̣�����BP���۵�Ƚ��ʯ�ͣ���ͼʾ��֪B-P����Ϊ�Ծ����Խ��ߵ�
=4��Bλ�ھ����ڣ���ĿΪ4����������Ļ�ѧʽΪBP������������һ�ֳ�Ӳ��ĥͿ����ϣ�����ԭ�Ӿ��壬��C��ԭ�Ӱ뾶��B��P��С����C��C�ļ�����B��P�����̣�����BP���۵�Ƚ��ʯ�ͣ���ͼʾ��֪B-P����Ϊ�Ծ����Խ��ߵ�![]() �����߳�Ϊ
�����߳�Ϊ![]() cm�����������Ϊ(
cm�����������Ϊ(![]() cm)3��1mol����������Ϊ4��42g���ʾ������ܶ�Ϊ(4��42g)��[NA��(
cm)3��1mol����������Ϊ4��42g���ʾ������ܶ�Ϊ(4��42g)��[NA��(![]() cm)3]=
cm)3]= g/cm3��
g/cm3��

 ��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�