题目内容
工业“从海水中提取镁”的流程图如图所示:
步骤为:
①将海边大量的贝壳煅烧成生石灰,并将生石灰制成石灰乳;
②将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
③在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2?6H2O;
④将MgCl2?6H2O在一定条件下加热得到无水MgCl2;
⑤电解熔融的氯化镁可得到Mg.
(1)步骤①中涉及的化学方程式为
(2)步骤③中的蒸发利用风吹日晒完成,但在实验室中蒸发操作时需要的主要仪器有
(3)海水中的镁以Mg抖形式存在,设计步骤②③将Mg2+转化为Mg(OH)2又重新转化为Mg2+的目的是
(4)步骤④中的“一定条件”指的是
(5)上述流程中,在降低成本、减少污染方面做了一些工作,请写出其中一点:
(6)有同学认为:可以在步骤②后加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,以简化实验步骤,体现实验的简约性原则.你是否同意该同学的观点
分析:(1)根据碳酸钙加热分解产生氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙;
(2)根据蒸发操作所用到的仪器分析;
(3)根据海水中镁离子的浓度低,需要富集镁元素;
(4)MgCl2在加热时易水解生成氢氧化镁沉淀,此时应防止水解;
(5)电解产生的Cl2用于制取HCl气体,实现盐酸循环利用;
(6)MgO熔点远高于MgCl2,应注意节约能源;
(2)根据蒸发操作所用到的仪器分析;
(3)根据海水中镁离子的浓度低,需要富集镁元素;
(4)MgCl2在加热时易水解生成氢氧化镁沉淀,此时应防止水解;
(5)电解产生的Cl2用于制取HCl气体,实现盐酸循环利用;
(6)MgO熔点远高于MgCl2,应注意节约能源;
解答:解:(1)碳酸钙加热分解产生氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,方程式分别为:CaCO3
CaO+CO2↑(2分);CaO+H2O=Ca(OH)2;
故答案为:CaCO3
CaO+CO2↑;CaO+H2O=Ca(OH)2;
(2)蒸发过程所用到的仪器有蒸发皿、玻璃棒、酒精灯、三角架、坩埚钳等,
故答案为:蒸发皿,玻璃棒;
(3)海水中镁离子的浓度低,需要富集镁元素,提高Mg2+的浓度;
故答案为:提高Mg2+的浓度,起到富集的作用;
(4)MgCl2在加热时易水解生成氢氧化镁沉淀,此时应防止水解,则应在HCl氛围中,同时可以带走水蒸气;
故答案为:在HCl气流中;抑制MgCl2水解成Mg(OH)2;可以带走水蒸气;
(5)电解产生的Cl2用于制取HCl气体,实现盐酸循环利用,减少了环境污染,
故答案为:电解产生的Cl2用于制取HCl气体;
(6)MgO熔点远高于MgCl2,应注意节约能源,可用氯化镁代替.
故答案为:不同意;因为MgO熔点很高,熔融时耗费大量的能量增加生产成本.
| ||
故答案为:CaCO3
| ||
(2)蒸发过程所用到的仪器有蒸发皿、玻璃棒、酒精灯、三角架、坩埚钳等,
故答案为:蒸发皿,玻璃棒;
(3)海水中镁离子的浓度低,需要富集镁元素,提高Mg2+的浓度;
故答案为:提高Mg2+的浓度,起到富集的作用;
(4)MgCl2在加热时易水解生成氢氧化镁沉淀,此时应防止水解,则应在HCl氛围中,同时可以带走水蒸气;
故答案为:在HCl气流中;抑制MgCl2水解成Mg(OH)2;可以带走水蒸气;
(5)电解产生的Cl2用于制取HCl气体,实现盐酸循环利用,减少了环境污染,
故答案为:电解产生的Cl2用于制取HCl气体;
(6)MgO熔点远高于MgCl2,应注意节约能源,可用氯化镁代替.
故答案为:不同意;因为MgO熔点很高,熔融时耗费大量的能量增加生产成本.
点评:本题以从海水中提取镁为背景,考查物质的分离、提纯,盐类水解,节能减排等知识,培养了学生运用知识的能力.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
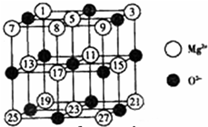 (2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.
(2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.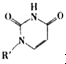 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b: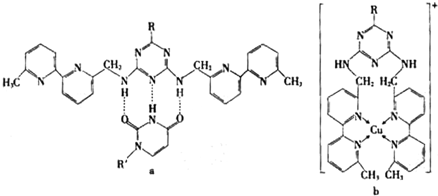

 Mg(OH)2
Mg(OH)2 Mg
Mg
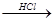 MgCl2溶液
MgCl2溶液 MgCl2熔融
MgCl2熔融 Mg(OH)2
Mg(OH)2 MgO
MgO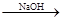 Mg(OH)2
Mg(OH)2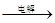 Mg
Mg 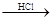 MgCl2溶液
MgCl2溶液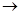 MgCl2熔融
MgCl2熔融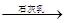 Mg(OH)2
Mg(OH)2 MgO
MgO