题目内容
氯化铜、氯化亚铜是重要的化工原料,广泛地用作有机合成催化剂。
实验室中以粗铜(含杂质Fe)为原料,某种制备铜的氯化物的流程如下。

按要求回答下列问题:
(1)操作①的名称是______________,检验溶液2中是否含有杂质离子的试剂是?????????????????? 。操作②需在氯化氢气流中经过加热浓缩、??????? 、过滤、洗涤、干燥。
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是??????????????????????? ;
溶液1可加试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)___________。
a.NaOH???????? b.NH3·H2O??????? c.CuO?????? d.CuSO4
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式: ????????????????????? 。
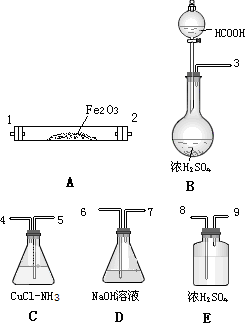
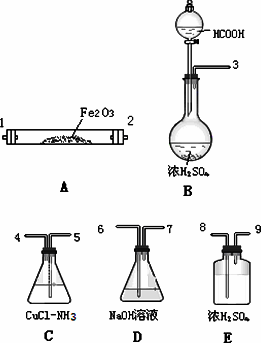
(4)现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。

①按气流方向连接各仪器接口顺序是:a→?? 、 → 、 → 、 → 。实验开始前要进行一步重要操作,其操作名称是?????????????????????????? 。
②反应时,盛粗铜粉的试管中的现象是?????????????????? ??????????? 。
③反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化腐蚀过程中的正极反应式为??????????????? 。
(1)过滤;KSCN溶液;冷却结晶(结晶)
(2)抑制氯化铜、氯化铁水解(1分); c(1分)
(3)2Cu2++2Cl-+SO2+2H2O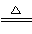 2CuCl↓+4H++SO42- (2分)
2CuCl↓+4H++SO42- (2分)
(4)①dejhfgb(2分); 检查装置的气密性(1分)
②产生大量棕黄色烟(1分)
③ClO-+2e-+H2O=Cl-+2OH-(2分)
【解析】
试题分析:(1)经过操作①得到固体和溶液,所以该操作为过滤;杂质Fe与Cl2反应转化为Fe3+,所以用KSCN溶液检验;热溶液经过冷却结晶可得到晶体。
(2)CuCl2和FeCl3均为强酸弱碱盐,能发生水解反应,水解产物均有HCl,加稀盐酸溶解,能抑制氯化铜、氯化铁水解;试剂X作用为消耗H+,调节pH使杂质Fe3+转化为沉淀而除去,CuSO4不能消耗H+,NaOH与NH3?H2O会产生新的杂质离子,CuO既能消耗H+,又不会产生新杂质,故c项正确。
(3)溶液2含有CuCl2,通入一定量的的SO2,生成白色沉淀CuCl,发生氧化还原反应,SO2为还原剂,被氧化为SO42?,所以离子方程式为2Cu2++2Cl-+SO2+2H2O 2CuCl↓+4H++SO42-
2CuCl↓+4H++SO42-
(4)①KMnO4与浓盐酸制取的Cl2含有HCl和H2O,连接d e,用饱和食盐水除去HCl,连接j h,用浓硫酸除去H2O,然后连接f g,Cl2与Cu反应,再连接b,用NaOH溶液吸收未反应的Cl2;与气体有关的实验,实验开始前必需检验装置的气密性。
②Cl2与Cu反应的现象为:产生大量棕黄色烟。
③溶液会失去漂白、杀菌消毒功效,说明ClO?在正极上得电子,发生还原反应,正极方程式为:ClO-+2e-+H2O=Cl-+2OH-
考点:本题考查基本操作和基本仪器、反应现象、除杂试剂的选择、离子方程式书写、电极方程式的书写。