题目内容
【题目】4.35g二氧化锰在100mL足量浓盐酸(密度为1.19g/cm3、质量分数为36.5%)中完全反应:MnO2+4HCl![]() MnCl2+Cl2↑+2H2O。(Mn-55 O-16 H-1 Cl-35.5)
MnCl2+Cl2↑+2H2O。(Mn-55 O-16 H-1 Cl-35.5)
(1)表示上述氧化还原反应电子转移的方向和数目:__________________。
(2)浓盐酸中HCl的物质的量浓度:c(HCl)=___________。
(3)参加反应的HCl的物质的量:n(HCl)=______________。
【答案】(1)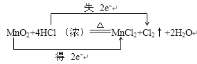
(2)11.9mol/L (3)0.2mol
【解析】
试题分析:(1)在MnO2+4HCl![]() MnCl2+Cl2↑+2H2O中MnO2是氧化剂,HCl是还原剂,用双线桥分析此反应的得失电子情况为
MnCl2+Cl2↑+2H2O中MnO2是氧化剂,HCl是还原剂,用双线桥分析此反应的得失电子情况为 ;
;
(2)根据c=![]() 可知,浓盐酸质量分数为36.5%,密度为1.19gcm-3,则该浓盐酸的物质的量浓度为
可知,浓盐酸质量分数为36.5%,密度为1.19gcm-3,则该浓盐酸的物质的量浓度为![]() mol/L=11.9mol/L;
mol/L=11.9mol/L;
(3)4.35g二氧化锰的物质的量为4.35g÷87g/mol=0.05mol,
MnO2+4HCl![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1mol 4mol
0.05mol nmol
则:n=0.05mol×4=0.2mol。

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目