题目内容
下表是元素周期表的一部分,回答下列有关问题:
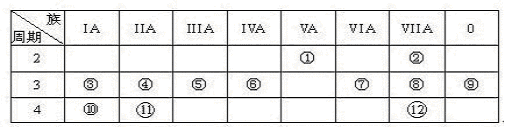
(1)写出下列元素符号:①________,⑥________,⑦________
(2)画出原子的结构示意图:④__________,⑧__________
(3)元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是( )
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(4)第三周期(除稀有气体元素)中原子半径最大的元素是 (填序号),跟它同周 期原子半径最小的元素是 (填序号),它们可以形成 (填离子或共价)化合物,用电子式表示其形成过程下:
(5)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑧形成一种AB4型的化合物,该化合物是(填分子式) 分子的空间构型为:

(1)写出下列元素符号:①________,⑥________,⑦________
(2)画出原子的结构示意图:④__________,⑧__________
(3)元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是( )
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(4)第三周期(除稀有气体元素)中原子半径最大的元素是 (填序号),跟它同周 期原子半径最小的元素是 (填序号),它们可以形成 (填离子或共价)化合物,用电子式表示其形成过程下:
(5)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑧形成一种AB4型的化合物,该化合物是(填分子式) 分子的空间构型为:
(1)N (1分)、 Si(1分)、 S(1分)
(2)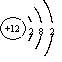 (1分) 、
(1分) 、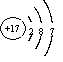 (1分)
(1分)
(3)Cl (1分) 、 b(1分)
(4)③(1分) 、 ⑧(1分) 、离子(1分)、
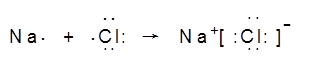 (2分)
(2分)
(5) CCl4(1分)、正四面体(1分)
(2)
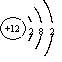 (1分) 、
(1分) 、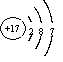 (1分)
(1分)(3)Cl (1分) 、 b(1分)
(4)③(1分) 、 ⑧(1分) 、离子(1分)、
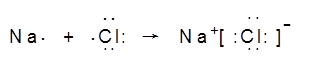 (2分)
(2分)
(5) CCl4(1分)、正四面体(1分)
考查对元素周期律及元素周期表的熟练应用
(1)三元素分别为氮、硅、硫
(2)两元素分别为镁、氯
(3)同周期自左向右非金属性增强,即⑦>⑧,也就是硫的非金属性稍强
比较两元素的非金属性的强弱,一般是通过其氢化物的稳定性及其最高价氧化物的水化物的酸性强弱来判定,即b说法正确,而a、c均与此无直接关系,排除
(4)同周期原子半径自左向右逐渐减小,金属性减弱,非金属性增强,钠、氯两元素分别易失去、得到一个电子,故可形成离子键形成离子化合物
(5)该元素核外电子只能为两层,K层2个电子,L层4个电子,即碳元素,与氯元素形成正四面体分子结构的CCl4分子
(1)三元素分别为氮、硅、硫
(2)两元素分别为镁、氯
(3)同周期自左向右非金属性增强,即⑦>⑧,也就是硫的非金属性稍强
比较两元素的非金属性的强弱,一般是通过其氢化物的稳定性及其最高价氧化物的水化物的酸性强弱来判定,即b说法正确,而a、c均与此无直接关系,排除
(4)同周期原子半径自左向右逐渐减小,金属性减弱,非金属性增强,钠、氯两元素分别易失去、得到一个电子,故可形成离子键形成离子化合物
(5)该元素核外电子只能为两层,K层2个电子,L层4个电子,即碳元素,与氯元素形成正四面体分子结构的CCl4分子

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
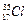 原子中含有 个质子, 个中子;它的原子结构示意图为 。铁在氯气中燃烧,生成 ,在这个反应中,氯气是 剂(填“氧化”,或“还原”)。
原子中含有 个质子, 个中子;它的原子结构示意图为 。铁在氯气中燃烧,生成 ,在这个反应中,氯气是 剂(填“氧化”,或“还原”)。 >c
>c