题目内容
(6分)在由铜片、锌片和200 mL稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况)的H2时,硫酸恰好用完,则:
① 产生这些气体消耗的锌的质量是多少?
② 通过导线的电子的物质的量是多少?
③ 原稀硫酸的物质的量浓度是多少?
【答案】
①9.75g ②0.3mol ③0.75mol/L
【解析】考查原电池的应该判断和计算。在原电池中较活泼的金属是负极,失去递增,发生氧化反应,因此锌是负极,铜是正极,溶液中的氢离子放电。
①3.36 L(标准状况)的H2是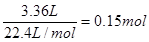
转移的电子是0.15mol×2=0.3mol
负极反应式为Zn-2e-=Zn2+
所以根据得失电子守恒可知消耗的锌是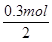 =0.15mol
=0.15mol
质量是0.15mol×65g/mol=9.75g
②根据①可知通过的电子的物质的量是0.3mol
③根据氢原子守恒可知原硫酸的物质的量为0.15mol
所以其浓度为

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案
相关题目