题目内容
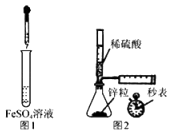
【题目】草酸晶体的组成可用H2C2O4xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶液.将25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amolL﹣1的KMnO4溶液滴定到KMnO4不再褪色为止.试回答:
(1)实验中不考虑铁架台等夹持仪器外,不需要的仪器有(填序号) , 还缺少的仪器有(填名称) .
a.托盘天平(带砝码,镊子) b.滴定管 c.100mL容量瓶 d.烧杯
e.漏斗 f.锥形瓶 g.玻璃棒 h.烧瓶
(2)实验中,标准液KMnO4溶液应装在式滴定管中.
(3)若在滴定前没有用amolL﹣1的KMnO4溶液对滴定管进行润洗,则所测得的x值会(偏大、偏小、无影响).
(4)在滴定过程中若用amolL﹣1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为molL﹣1 , 由此可计算x的值是 .
(5)写出酸性高锰酸钾溶液滴定草酸溶液过程中反应的离子方程式 .
【答案】
(1)ef;胶头滴管
(2)酸
(3)偏小
(4)0.1Av;![]()
(5)2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
【解析】解:(1)为了准确配制一定浓度浓度的草酸溶液,所需要的实验仪器主要为:天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等;
用高锰酸钾溶液进行滴定测草酸的物质的量,所需要的实验仪器主要有:烧杯、酸式滴定管、铁架台(带滴定管夹)、锥形瓶等,
则在以上操作中不需要的仪器有:e.漏斗 f.锥形瓶,还缺少胶头滴管,
所以答案是:ef;胶头滴管;
(2.)KMnO4溶液具有强氧化性,可以腐蚀碱式滴定管中的橡皮管,故KMnO4溶液应装在酸式滴定管中,所以答案是:酸;
(3.)在滴定前没有用amolL﹣1的KMnO4溶液对滴定管进行润洗,消耗的高锰酸钾偏多,则由2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O计算可知,测定H2C2O4的质量偏大,则H2C2O4xH2O中水的质量偏小,则x偏小,
所以答案是:偏小;
(4.)
2KMnO4 | ~ | 5H2C2O4 |
2 | 5 | |
aV×10﹣3mol | 0.025×cmol |
c= ![]() =0.1aVmolL﹣1 ,
=0.1aVmolL﹣1 ,
Wg草酸晶体,配成100.00mL水溶液,取25.00mL进行滴定实验,
则0.1aVmolL﹣1×0.1L×(90+18x)=W,
解得x= ![]() ,
,
所以答案是:0.1aV; ![]() ;
;
(5.)酸性高锰酸钾溶液滴定草酸溶液过程中反应的离子方程式为2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,
所以答案是:2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.

【题目】利用如图所示装置,采用适当试剂可完成下表的探究实验,并得出相应的实验结论,其中错误的是
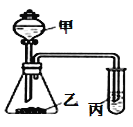
选项 | 甲 | 乙 | __丙 | 装置丙中的现象 | 实验结论 |
A | 稀硝酸 | 碳酸钾 | 澄淸石灰水 | 变浑浊 | 酸性:HNO3>H2CO3 |
B | 稀硫酸 | 碳酸钠 | 次氯酸钙溶液 | 白色沉淀 | 酸性:H2CO3>HClO |
C | 浓盐酸 | 大理石 | 硅酸钠溶液 | 白色沉淀 | 非金属性:C>Si |
D | 浓盐酸 | 高锰酸钾 | 石蕊溶液 | 先变红后褪色 | 氯水既有酸性,又具有漂白性 |
A. A B. B C. C D. D
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10﹣5 |
下列说法不正确的是( )
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10﹣5
C.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol/L
D.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v(正)>v(逆)