题目内容
(8分)碳元素是构成有机物的基础元素。
(1)写出碳元素核外电子排布式 。
(2)甲烷与水分子相对分子质量差距不大但溶沸点却有很大差距,原因是 。
(3)分析甲烷、乙烯、乙炔中碳原子杂化方式 。
(4)已知CO2晶胞结构如下,已知其晶胞边长为a cm,NA表示阿伏加德罗常数,其密度为 g/cm3。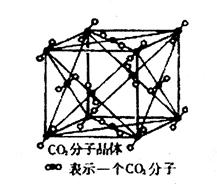
(1)写出碳元素核外电子排布式 。
(2)甲烷与水分子相对分子质量差距不大但溶沸点却有很大差距,原因是 。
(3)分析甲烷、乙烯、乙炔中碳原子杂化方式 。
(4)已知CO2晶胞结构如下,已知其晶胞边长为a cm,NA表示阿伏加德罗常数,其密度为 g/cm3。

(8分)(1)1s22s22p2(l分) (2)水分子间可形成氢键(2分)
(3)甲烷sp3;乙烯sp2;乙炔sp(3分);
(4) (2分)
(2分)
(3)甲烷sp3;乙烯sp2;乙炔sp(3分);
(4)
 (2分)
(2分)(1)根据构造原理可写出其核外电子排布式为1s22s22p2。
(2)水分子的沸点之所以大是由于水分子间可以形成氢键的缘故。碳原子杂化方式分别是
(3)甲烷、乙烯、乙炔的空间构型分别是正四面体、平面型、直线型,所以sp3、sp2、sp1.
(4)根据CO2晶胞结构可计算出含有的分子数为8×1/8+6×1/2=4,其物质的量是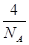 ,质量是
,质量是 ,所以其密度是
,所以其密度是 。
。
(2)水分子的沸点之所以大是由于水分子间可以形成氢键的缘故。碳原子杂化方式分别是
(3)甲烷、乙烯、乙炔的空间构型分别是正四面体、平面型、直线型,所以sp3、sp2、sp1.
(4)根据CO2晶胞结构可计算出含有的分子数为8×1/8+6×1/2=4,其物质的量是
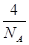 ,质量是
,质量是 ,所以其密度是
,所以其密度是 。
。
练习册系列答案
相关题目



