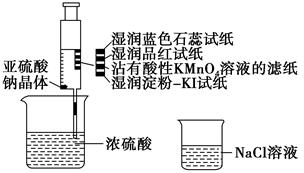
题目内容
(7分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就三大酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解。该反应的化学方程式为:__________________________________。
(2)在一定体积的18 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为______________。
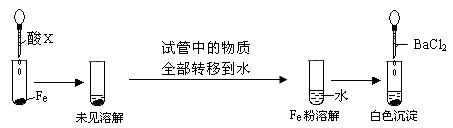
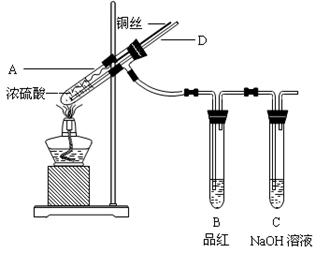
(3)根据下图操作及现象推断酸X为_______(填序号)。
a.浓盐酸 b.浓硫酸 c.浓硝酸
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解。该反应的化学方程式为:__________________________________。
(2)在一定体积的18 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为______________。
(3)根据下图操作及现象推断酸X为_______(填序号)。

a.浓盐酸 b.浓硫酸 c.浓硝酸
(7分)(1) Cu+H2O2+2HCl ="=" CuCl2+2H2O(2分)
(2)大于(1分);3Cu+8H++2NO3— ="=" 3Cu2++2NO↑+4H2O(2分)
(3)b(2分)
(2)大于(1分);3Cu+8H++2NO3— ="=" 3Cu2++2NO↑+4H2O(2分)
(3)b(2分)
试题分析:(1)在氧化剂过氧化氢的作用下把铜氧化成了铜离子,过氧化氢被还原为水,故方程式为: Cu+H2O2+2HCl ="=" CuCl2+2H2O;(2)铜只与浓硫酸反应,与稀硫酸不反应,故被还原的硫酸为0.9mol,反应掉的硫酸为1.8mol,反应后的溶液中还存在硫酸,故反应前硫酸的物质的量大于1.8mol,溶液的体积大于100ml;溶液中有氢离子,加入硝酸盐提供硝酸根离子,氢离子和硝酸根离子把铜氧化,故方程式为:3Cu+8H++2NO3— ="=" 3Cu2++2NO↑+4H2O(2分);(3)铁和浓盐酸反应,排除a;铁放入浓硫酸、浓硝酸中,常温下钝化,把试管中的物质转移到水中,把浓硫酸稀释,铁粉和稀的硫酸反应生成硫酸亚铁,加入氯化钡生成硫酸钡沉淀,而铁和稀的硝酸反应生成硝酸铁,加氯化钡不反应;故选B。

练习册系列答案
相关题目
 R-CH(OH)SO3Na
R-CH(OH)SO3Na
 溶液变蓝色
溶液变蓝色