题目内容
有一金属钠和过氧化钠的混合物,与过量水充分反应后,产生2.8 L气体(标准状况下),用电火花点燃充分反应后恢复到标准状态,气体压强几乎为零,则原混合物中钠与过氧化钠的物质的量之比为( )
| A.1∶3 | B.3∶1 | C.2∶1 | D.1∶2 |
C
因为金属钠、过氧化钠与水反应后产生H2、O2的气体混合物,而混合气用电火花点燃后气体压强几乎为零,说明氢气和氧气刚好完全反应,据反应2H2+O2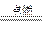 2H2O可知,此时生成的H2和O2的物质的量之比为2∶1,又据反应:2Na+2H2O====2NaOH+H2↑,2Na2O2+2H2O====4NaOH+O2↑,可得如下关系:2Na—H2、2Na2O2—O2,很显然,此时原混合物中钠与过氧化钠的物质的量之比一定恒为2∶1(与产生了多少升混合气体没关系),故本题答案为C。
2H2O可知,此时生成的H2和O2的物质的量之比为2∶1,又据反应:2Na+2H2O====2NaOH+H2↑,2Na2O2+2H2O====4NaOH+O2↑,可得如下关系:2Na—H2、2Na2O2—O2,很显然,此时原混合物中钠与过氧化钠的物质的量之比一定恒为2∶1(与产生了多少升混合气体没关系),故本题答案为C。
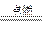 2H2O可知,此时生成的H2和O2的物质的量之比为2∶1,又据反应:2Na+2H2O====2NaOH+H2↑,2Na2O2+2H2O====4NaOH+O2↑,可得如下关系:2Na—H2、2Na2O2—O2,很显然,此时原混合物中钠与过氧化钠的物质的量之比一定恒为2∶1(与产生了多少升混合气体没关系),故本题答案为C。
2H2O可知,此时生成的H2和O2的物质的量之比为2∶1,又据反应:2Na+2H2O====2NaOH+H2↑,2Na2O2+2H2O====4NaOH+O2↑,可得如下关系:2Na—H2、2Na2O2—O2,很显然,此时原混合物中钠与过氧化钠的物质的量之比一定恒为2∶1(与产生了多少升混合气体没关系),故本题答案为C。
练习册系列答案
相关题目
 CuSO4+5H2O,CuSO4
CuSO4+5H2O,CuSO4 CuO+SO3
CuO+SO3 2Cu2O+O2,2SO3
2Cu2O+O2,2SO3 2SO2+O2
2SO2+O2