题目内容
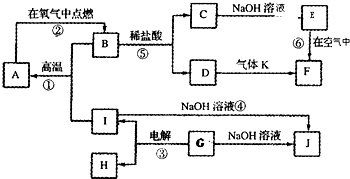
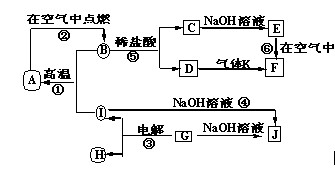
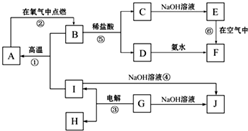 A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:(1)A、B、C、D、E、F六种物质中所含的同一种元素在周期表中的位置
第四周期第Ⅷ族
第四周期第Ⅷ族
.(2)写出反应①、⑥的化学方程式.
反应①:
8Al+3Fe3O4
9Fe+4Al2O3
| ||
8Al+3Fe3O4
9Fe+4Al2O3
;
| ||
反应⑥:
4Fe(OH)2+O2+2H2O═4Fe(OH)3
4Fe(OH)2+O2+2H2O═4Fe(OH)3
.分析:G为主族元素的固态氧化物,可以和氢氧化钠反应,判断为两性氧化物,应为Al2O3,与NaOH反应生成NaAlO2,则J为NaAlO2,电解生成O2和Al,由反应④可知,I为Al,则H为O2,F为红褐色沉淀,则应为Fe(OH)3,则D为FeCl3,E为Fe(OH)2,C为FeCl2,所以B为Fe3O4,与Al在高温下发生铝热反应生成A,A为Fe,根据物质的性质可进一步书写有关反应的化学方程式.
解答:解:(1)G主族元素的固态氧化物,可以和氢氧化钠反应,判断为两性氧化物,应为Al2O3,与NaOH反应生成NaAlO2,则J为NaAlO2,电解生成O2和Al,由反应④可知,I为Al,则H为O2,F为红褐色沉淀,则应为Fe(OH)3,则D为FeCl3,E为Fe(OH)2,C为FeCl2,所以B为Fe3O4,与Al在高温下发生铝热反应生成A,A为Fe,所以A、B、C、D、E、F六种物质中所含的同一种元素是Fe,Fe位于周期表中在第四周期第Ⅷ族,
故答案为:第四周期第Ⅷ族;
(2)由(1)分析可知,反应①Fe3O4为与Al在高温下发生铝热反应生成Fe,反应的方程式为8Al+3Fe3O4
9Fe+4Al2O3,反应⑥为具有还原性的Fe(OH)2与空气中的氧气反应生成Fe(OH)3,反应的方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:8Al+3Fe3O4
9Fe+4Al2O3;4Fe(OH)2+O2+2H2O═4Fe(OH)3.
故答案为:第四周期第Ⅷ族;
(2)由(1)分析可知,反应①Fe3O4为与Al在高温下发生铝热反应生成Fe,反应的方程式为8Al+3Fe3O4
| ||
| ||
点评:本题考查无机物的推断,题目难度中等,本题注意根据物质的性质和典型反应现象用逆推的方法,正确推断物质的种类是解答该题的关键.

练习册系列答案
相关题目

 NH3?H2O+H+
NH3?H2O+H+