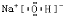题目内容
 Ⅰ.X、Y、Z是短周期元素的三种常见氧化物.X跟水反应可生成一种具有还原性的不稳定的二元酸,该酸的化学式是______;Y和X组成元素相同,Y与水反应生成M,足量M的浓溶液与3.2g Cu在加热条件下充分反应,其中被还原的M的物质的量为______.固态Z可应用于人工降雨,0.5mol?L-1Z与NaOH反应所得的正盐水溶液中,离子浓度从大到小的顺序为______.
Ⅰ.X、Y、Z是短周期元素的三种常见氧化物.X跟水反应可生成一种具有还原性的不稳定的二元酸,该酸的化学式是______;Y和X组成元素相同,Y与水反应生成M,足量M的浓溶液与3.2g Cu在加热条件下充分反应,其中被还原的M的物质的量为______.固态Z可应用于人工降雨,0.5mol?L-1Z与NaOH反应所得的正盐水溶液中,离子浓度从大到小的顺序为______.
Ⅱ.N2O5是一种新型硝化剂,其性质和制备受到人们的关注.现以H2、O2、熔融盐Na2CO3组成的燃料电池,其中Y为CO2;采用电解法制备N2O5,总的反应方程式为:N2O4+2HNO3=2N2O5+H2,装置如图所示.
写出石墨I电极上发生反应的电极反应式______.
在电解池中生成N2O5的电极反应式为______.
Ⅲ.烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
(1)烟气脱硫、脱硝对环境的意义______.
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图1.
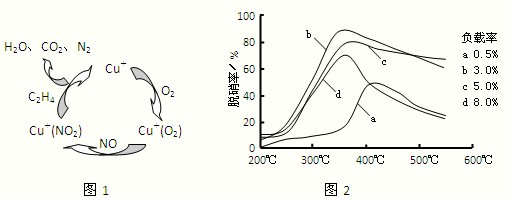
脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示.
①写出该脱硝原理总反应的化学方程式:______.②为达到最佳脱硝效果,应采取的条件是______.
解:Ⅰ、常见的二元含氧酸有H2SO4、H2SO3、H2CO3、H2SiO3,具有还原性的二元含氧酸为亚硫酸,化学式是H2SO3,所以X为二氧化硫;
Y和X组成元素相同,所以Y是三氧化硫,M是硫酸,浓硫酸和铜反应的方程式为
Cu+H2SO4(浓)+H2SO4(浓) (被还原硫酸) CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O,
64g 1mol
3.2g 0.05mol
所以被还原的硫酸为0.05mol;
固态可应用于人工降雨的氧化物为二氧化碳,所以Z是二氧化碳,二氧化碳与NaOH反应所得的正盐为碳酸钠,碳酸钠是强碱弱酸盐,所以能电离也能水解,只是电离程度大于水解程度,所以碳酸根离子浓度大于碳酸氢根离子浓度;碳酸是二元弱酸,所以碳酸根离子能发生两步水解,第一步水解程度大于第二步水解程度,碳酸根离子每步都有氢氧根离子生成,所以氢氧根离子的浓度大于碳酸氢根离子的浓度;碳酸钠是强碱弱酸盐,其水溶液呈碱性,所以氢氧根离子浓度大于氢离子浓度,所以溶液中离子的浓度大小为C(Na+)>C(CO32- )>C(OH-)>C(HCO3-)>C(H+),
故答案为:H2SO3;0.05mol;C(Na+)>C(CO32- )>C(OH-)>C(HCO3-)>C(H+);
Ⅱ、燃料原电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为H2+CO32--2e-=CO2+H2O;
N2O5中氮元素的化合价是+5价,而硝酸中氮元素也是+5价.因此应该在左侧生成N2O5,即在阳极区域生成,据电极反应离子放电顺序可知:阴极发生2H++2e-=H2↑的反应,则阳极为N2O4+2HNO3-2e-=2N2O5+2H+.
故答案为:H2+CO32--2e-=CO2+H2O;N2O4+2HNO3-2e-=2N2O5+2H+;
Ⅲ、(1)、SO2和氮的氧化物(NOx)是引起酸雨的主要物质,所以烟气脱硫、脱硝的环境意义是防止酸雨、光化学烟雾的发生,故答案为:防止酸雨、光化学烟雾的发生;
(2)①由图1知,反应物为一氧化氮、氧气、乙烯,铜为催化剂,生成物为氮气、二氧化碳和水,反应方程式为6NO+3O2+2C2H4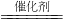 3N2+4CO2+4H2O,
3N2+4CO2+4H2O,
故答案为:6NO+3O2+2C2H4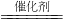 3N2+4CO2+4H2O;;
3N2+4CO2+4H2O;;
②满足脱硝率高,负载率低,适宜的温度,由图可知,适合条件为350℃、负载率3%,故答案为:350℃、负载率3%.
分析:Ⅰ常见的二元酸有H2SO4、H2SO3、H2CO3、H2SiO3,根据二元酸是否有还原性判断X,从而确定该酸的化学式;
根据题意结合x确定Y、M的化学式,根据M和铜的反应方程式计算被还原的M的物质的量;
根据“能用于人工降雨且是氧化物”确定Z,根据Z和氢氧化钠反应的生成物的性质确定溶液中各离子的相对大小;
Ⅱ、燃料原电池中,负极上燃料失电子发生氧化反应;先根据化合价判断生成N2O5的电极,再根据离子的放电顺序写出电极反应式;
Ⅲ.(1)SO2和氮的氧化物(NOx)是引起酸雨的主要物质,氮的氧化物(NOx)也是引起光化学烟雾主要物质;
(2)①根据图1确定反应物、生成物,写出反应方程式;
②脱硝率高,负载率低,适宜的温度.
点评:本题考查了原电池和电解池的工作原理及图象的分析,难度较大,易错题为Ⅱ题,会根据化合价的变化确定生成N2O5的电极,根据离子的放电顺序写出相应的电极反应式.
Y和X组成元素相同,所以Y是三氧化硫,M是硫酸,浓硫酸和铜反应的方程式为
Cu+H2SO4(浓)+H2SO4(浓) (被还原硫酸)
 CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O,64g 1mol
3.2g 0.05mol
所以被还原的硫酸为0.05mol;
固态可应用于人工降雨的氧化物为二氧化碳,所以Z是二氧化碳,二氧化碳与NaOH反应所得的正盐为碳酸钠,碳酸钠是强碱弱酸盐,所以能电离也能水解,只是电离程度大于水解程度,所以碳酸根离子浓度大于碳酸氢根离子浓度;碳酸是二元弱酸,所以碳酸根离子能发生两步水解,第一步水解程度大于第二步水解程度,碳酸根离子每步都有氢氧根离子生成,所以氢氧根离子的浓度大于碳酸氢根离子的浓度;碳酸钠是强碱弱酸盐,其水溶液呈碱性,所以氢氧根离子浓度大于氢离子浓度,所以溶液中离子的浓度大小为C(Na+)>C(CO32- )>C(OH-)>C(HCO3-)>C(H+),
故答案为:H2SO3;0.05mol;C(Na+)>C(CO32- )>C(OH-)>C(HCO3-)>C(H+);
Ⅱ、燃料原电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为H2+CO32--2e-=CO2+H2O;
N2O5中氮元素的化合价是+5价,而硝酸中氮元素也是+5价.因此应该在左侧生成N2O5,即在阳极区域生成,据电极反应离子放电顺序可知:阴极发生2H++2e-=H2↑的反应,则阳极为N2O4+2HNO3-2e-=2N2O5+2H+.
故答案为:H2+CO32--2e-=CO2+H2O;N2O4+2HNO3-2e-=2N2O5+2H+;
Ⅲ、(1)、SO2和氮的氧化物(NOx)是引起酸雨的主要物质,所以烟气脱硫、脱硝的环境意义是防止酸雨、光化学烟雾的发生,故答案为:防止酸雨、光化学烟雾的发生;
(2)①由图1知,反应物为一氧化氮、氧气、乙烯,铜为催化剂,生成物为氮气、二氧化碳和水,反应方程式为6NO+3O2+2C2H4
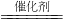 3N2+4CO2+4H2O,
3N2+4CO2+4H2O,故答案为:6NO+3O2+2C2H4
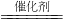 3N2+4CO2+4H2O;;
3N2+4CO2+4H2O;;②满足脱硝率高,负载率低,适宜的温度,由图可知,适合条件为350℃、负载率3%,故答案为:350℃、负载率3%.
分析:Ⅰ常见的二元酸有H2SO4、H2SO3、H2CO3、H2SiO3,根据二元酸是否有还原性判断X,从而确定该酸的化学式;
根据题意结合x确定Y、M的化学式,根据M和铜的反应方程式计算被还原的M的物质的量;
根据“能用于人工降雨且是氧化物”确定Z,根据Z和氢氧化钠反应的生成物的性质确定溶液中各离子的相对大小;
Ⅱ、燃料原电池中,负极上燃料失电子发生氧化反应;先根据化合价判断生成N2O5的电极,再根据离子的放电顺序写出电极反应式;
Ⅲ.(1)SO2和氮的氧化物(NOx)是引起酸雨的主要物质,氮的氧化物(NOx)也是引起光化学烟雾主要物质;
(2)①根据图1确定反应物、生成物,写出反应方程式;
②脱硝率高,负载率低,适宜的温度.
点评:本题考查了原电池和电解池的工作原理及图象的分析,难度较大,易错题为Ⅱ题,会根据化合价的变化确定生成N2O5的电极,根据离子的放电顺序写出相应的电极反应式.

练习册系列答案
相关题目