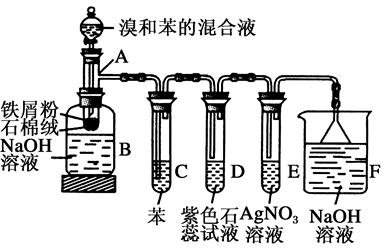
题目内容
有机物X含有碳、氢、氧三种元素。
(1)探究X与钠反应产生气体的成分。
①X与钠反应产生的气体具有可燃性。将气体点燃,把一干燥的小烧杯罩在火焰上,片刻在烧杯壁上出现液滴,迅速倒转烧杯,向烧杯中加入少量澄清石灰水,未见浑浊。则X与钠反应产生的气体为________。
②根据苯、乙烷等碳氢化合物不能与钠反应产生上述气体这一事实,可得出X分子里有不同于烃分子里的氢原子存在。即有机物X除含有碳氢键之外,还有的化学键是________键。
(2)工业上, X可由乙烯与水反应制得,则X的分子式是________。
X分子含有的官能团的名称是________。写出X发生催化氧化反应的化学方程式______________。
X能被酸性高锰酸钾或重铬酸钾氧化为生活中的另一种重要的有机化合物Y,X与Y发生反应的化学方程式是________________。为了提高该反应的反应速率,可采取的措施是_______________。可用某溶液除去产品中混有的杂质,写出除杂过程发生反应的化学反应方程式______________________。
(1)①氢气②氢氧 (2)C2H6O 羟基 2CH3CH2OH+O2  2CH3CHO+2H2O
2CH3CHO+2H2O
(3)CH3COOH+CH3CH2OH  CH3COOCH2CH3+H2O 加热,使用催化剂浓硫酸 2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑
CH3COOCH2CH3+H2O 加热,使用催化剂浓硫酸 2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑
解析试题分析:(1)烧杯壁上出现液滴,证明有水生成,向烧杯中加入少量澄清石灰水未出现浑浊,证明无二氧化碳,又有有机物X含有碳氢氧三中元素,且该气体具有可燃性,说明该气体为氢气。 能与钠反应的有机物具有H-O键。
(2)乙烯与水反应的产物为为乙醇,分子式为C2H6O,官能团为羟基。化学反应方程式为 2CH3CH2OH+O2  2CH3CHO+2H2O
2CH3CHO+2H2O
(3)乙醇被酸性高锰酸钾或重铬酸钾氧化为乙醇,其化学方程式为CH3COOH+CH3CH2OH  CH3COOCH2CH3+H2O 。加热可以提高反应速率,使用催化剂同样能增加反应速率。 此实验中主要杂质为乙酸和乙醇,用饱和碳酸钠溶液可以与乙酸发生反应,与乙醇互溶,且乙酸乙酯在饱和碳酸钠溶液中溶解度非常小。
CH3COOCH2CH3+H2O 。加热可以提高反应速率,使用催化剂同样能增加反应速率。 此实验中主要杂质为乙酸和乙醇,用饱和碳酸钠溶液可以与乙酸发生反应,与乙醇互溶,且乙酸乙酯在饱和碳酸钠溶液中溶解度非常小。
考点:化学实验思维考查。重点考查乙烯、乙醇、乙酸的化学性质及重要反应。

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 (12分)l,2二溴乙烷可作汽油抗爆剂的添加剂,常温 下它是无色液体,密度2.189.cm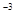 ,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在 实验室中可用下列反应制备1,2二溴乙烷。
,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在 实验室中可用下列反应制备1,2二溴乙烷。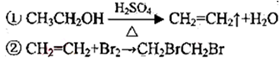
某化学兴趣小组用如图所示的装置(部分固定和夹持装置省略)进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。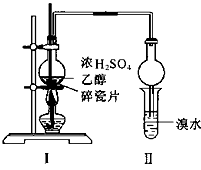
回答下列问题:
(1)已知该实验的副反应之一是乙醇会被浓硫酸氧化成CO2。写出该反应的化学方程式:
_________________________________________________________________。
(2)甲同学认为:溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理
由是________(填正确答案的标号,下同)。
| A.乙烯与溴水易发生取代反应 |
| B.使溴水褪色的物质,未必是乙烯 |
| C.使溴水褪色的反应,未必是加成反应 |
| D.浓硫酸氧化乙醇生成的乙醛,也会使溴水褪色 |
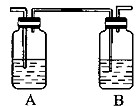
(4)丙同学对上述实验进行了改进,在I和II之间增加如图所示的装置,则A中的试剂为________,其作用是________B中的试剂为________,其作用是________。
(5)丁同学通过洗涤、蒸馏等操作对l,2一二溴乙烷粗品进行了精制。该洗涤操作用到的主要玻璃仪器是_________,该仪器在使用前须清洗干净并_________。
Ⅰ.如图是石油分馏塔的示意图。a、b、c三种馏分中________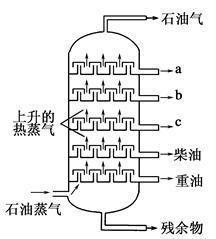
| A.a的沸点最高 |
| B.b的熔点最低 |
| C.c的平均相对分子质量最大 |
| D.每一种馏分都是纯净物 |
(1)先逐滴加入________,振荡,如果看到______,则证明有________存在。
(2)继续逐滴加入________至________为止,静置,用分液漏斗分出________(填“上”或“下”)层的裂化汽油样品,再加入________振荡,如果看到________,则证明裂化汽油中有________存在。
假酒中严重超标的有毒成分是:
| A.CH3CH2OH | B.CH3OH | C.CH3COOCH2CH3 | D.CH3COOH |
 +
+

 。
。 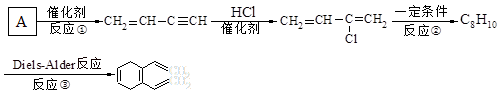
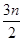 mol。
mol。