题目内容
【题目】甲、乙、丙是都含有同一种元素的不同物质,转化关系如下图:
![]()
![]()
![]()
![]()
![]()
(1)若甲是CO2。
①常用于泡沫灭火器的是________(填“乙”或“丙”,下同)。
②浓度均为0.01 mol·L-1的乙溶液和丙溶液中,水的电离程度较大的是__________。
(2)若甲是Al。
①Al的原子结构示意图为___________。
②当n(Al)∶n(NaOH)∶n(H2SO4)=1∶1∶2时,丙的化学式是__________。
(3)若甲是Cl2。
①甲转化为乙的离子方程式是_________________________。
②常温下,将a mol·L-1乙溶液和0.01 mol·L-1H2SO4溶液等体积混合生成丙,溶液呈中性,则丙的电离平衡常数Ka=____________(用含a的代数式表示)。
【答案】 乙 乙 ![]() Al2(SO4)3 Cl2+2OH-===Cl-+ClO-+H2O (
Al2(SO4)3 Cl2+2OH-===Cl-+ClO-+H2O (![]() -0.01)×10-5
-0.01)×10-5
【解析】(1)二氧化碳与氢氧化钠反应生成碳酸钠(碳酸氢钠),再与硫酸反应生成硫酸钠,①常用作泡沫灭火器的是NaHCO3,故为乙;②浓度相同的碳酸氢钠溶液和硫酸钠溶液中,HCO3-水解,故乙溶液中水的电离程度大;(2)金属铝是13号元素,原子结构示意图为![]() ②n(Al)=n(NaOH)时,生成偏铝酸钠,根据方程式:2NaAlO2 + 4H2SO4 =Na2SO4 + Al2(SO4)3 + 4H2O可知,NaAlO2与H2SO4 的物质的量之比为1:2,符合题意,故丙的化学式是 Al2(SO4)3 ;(3)若甲是氯气,与氢氧化钠生成氯化钠和次氯酸钠,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;③根据电荷守恒可得到:c(Na+)+c(H+)=c(OH-)+c(ClO-)+2c(SO42-);其中,溶液显中性即c(H+)=c(OH-),故c(Na+)=c(ClO-)+2c(SO42-);又根据物料守恒可得到:c(Na+)=c(ClO-)+c(HClO),即c(ClO-)=c(Na+)-2c(SO42-)、c(HClO)=c(Na+)-c(ClO-)=c(Na+)-[c(Na+)-2c(SO42-)]=2c(SO42-);Ka=
②n(Al)=n(NaOH)时,生成偏铝酸钠,根据方程式:2NaAlO2 + 4H2SO4 =Na2SO4 + Al2(SO4)3 + 4H2O可知,NaAlO2与H2SO4 的物质的量之比为1:2,符合题意,故丙的化学式是 Al2(SO4)3 ;(3)若甲是氯气,与氢氧化钠生成氯化钠和次氯酸钠,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;③根据电荷守恒可得到:c(Na+)+c(H+)=c(OH-)+c(ClO-)+2c(SO42-);其中,溶液显中性即c(H+)=c(OH-),故c(Na+)=c(ClO-)+2c(SO42-);又根据物料守恒可得到:c(Na+)=c(ClO-)+c(HClO),即c(ClO-)=c(Na+)-2c(SO42-)、c(HClO)=c(Na+)-c(ClO-)=c(Na+)-[c(Na+)-2c(SO42-)]=2c(SO42-);Ka=![]() =
=![]() =
=![]() =(
=(![]() -0.01)×10-5 。
-0.01)×10-5 。

 全优点练单元计划系列答案
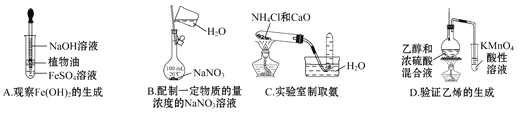
全优点练单元计划系列答案【题目】下列实验的现象与对应结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
C | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
【题目】根据表提供的数据,下列判断正确的是
弱酸化学式 | CH3COOH | HClO | H2CO3 |
电离平衡常数 | 1.8×10-6 | 3.0×10-8 | Ka1=4.3×10-7 Ka2=5.6×l0-11 |
A. 等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(CH3COO-)
B. 常温下,已知酸H2A存在如下平衡:H2A![]() H++HA-;HA-
H++HA-;HA-![]() H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
C. 相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:C(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
D. 常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5
【题目】过氧化尿素是一种新型漂泊、消毒剂,广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:
CO(NH2)2+H2O2![]() CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程及反应装置图如图:

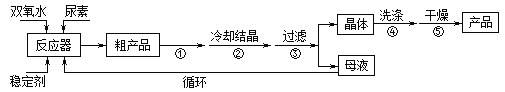
请回答下列问题:
(1)仪器X的名称是__________;冷凝管中冷却水从____(填“a”或“b”)口出来;
(2)该反应的温度控制30℃而不能过高的原因是_______________________。
(3)步骤①宜采用的操作是_____________。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是_________________。
(5)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为_____________;若滴定后俯视读数,则测得的过氧化尿素含量________(填“偏高”、“偏低”或“不变”)。