题目内容
江苏省东海县矿产丰富,除了水晶制品名扬天下外,蛭石、蛇纹石等矿石储量大,品位高,其相关的耐火、保温隔热材料(主要成分为MgO、Al2O3)工业也较发达。某中学化学探究小组通过查阅相关资料,对蛭石的组成进行了实验探究。
Ⅰ.相关资料:①蛭石的成分可看成是由MgO、Fe2O3、Al2O3、SiO2组成;
②氢氧化物开始沉淀及沉淀完全时的pH:
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 |
沉淀的pH范围 | 1.5~4.1 | 9.4~12.4 | 3.3~5.2 |
Ⅱ.相关实验:
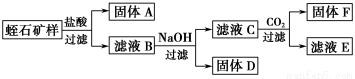
Ⅲ.实验数据:
①矿石样品质量为:8.22 g
②实验过程中得到固体的质量:A—2.40 g、D—2.14 g、F—1.56 g
③每次转化所得固体成分只有一种
请你根据以上内容和中学化学知识回答以下问题:
(1)过滤操作需要的玻璃仪器有:_____________________________________。
(2)写出由D制一种红色颜料的化学方程式:_____________________________________。
(3)工业上的耐火材料通常由F及滤液E进一步转化而成,请你根据滤液E中可能含有的成分,设计一个从滤液E制取耐火材料的实验方法:__________________________。
(4)滤液B与NaOH溶液反应时,应控制溶液的pH在7~8之间,这是因为_______________________________________________________。
(5)通过计算,写出用氧化物的形式表示蛭石组成的化学式:___________________________。
(1)漏斗、烧杯、玻璃棒
(2)2Fe(OH)3 Fe2O3+3H2O
Fe2O3+3H2O
(3)将所得的滤液E加热煮沸一定时间(或向滤液中加入足量的NaOH溶液),再进行过滤、洗涤、干燥,最后进行高温灼烧
(4)根据表中数据,控制溶液的pH在7~8之间,Mg2+没有变化,Al3+转化为AlO2-,只有Fe(OH)3沉淀
(5)8MgO·Al2O3·Fe2O3·4SiO2
【解析】本题关键是要看明白流程图各步的反应以及原理。混合物MgO、Fe2O3、Al2O3、SiO2加入盐酸,得固体A为SiO2,滤液中加入氢氧化钠得沉淀D为Fe(OH)3,滤液C中含有Mg2+和AlO2-,通入CO2生成Al(OH)3沉淀。(1)过滤操作所需的玻璃仪器:漏斗、烧杯、玻璃棒。(2)D制一种红色颜料的化学方程式:2Fe(OH)3 Fe2O3+3H2O。(3)所得的滤液E中含有Mg2+,因而可加入碱生成氢氧化镁沉淀,然后加热分解即得耐火材料氧化镁。(4)根据表中数据,控制溶液的pH在7~8之间,Mg2+没有变化,Al3+转化为AlO2-,只有Fe(OH)3沉淀。
Fe2O3+3H2O。(3)所得的滤液E中含有Mg2+,因而可加入碱生成氢氧化镁沉淀,然后加热分解即得耐火材料氧化镁。(4)根据表中数据,控制溶液的pH在7~8之间,Mg2+没有变化,Al3+转化为AlO2-,只有Fe(OH)3沉淀。
(5)n(SiO2)= =0.04 mol
=0.04 mol
2Fe(OH)3 Fe2O3+3H2O
Fe2O3+3H2O
214 g 1 mol
2.14 g n(Fe2O3)
列式解得:n(Fe2O3)=0.01 mol
m(Fe2O3)=0.01 mol×160 g·mol-1=1.60 g
2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
156 g 1 mol
1.56 g n(Al2O3)
列式解得:n(Al2O3)=0.01 mol
m(Al2O3)=0.01 mol×102 g·mol-1=1.02 g
m(MgO)=8.22 g-2.40 g-1.60 g-1.02 g=3.20 g
n(MgO)= =0.08 mol
=0.08 mol
则n(MgO)∶n(Fe2O3)∶n(Al2O3)∶n(SiO2)=0.08 mol∶0.01 mol∶0.01 mol∶0.04 mol=8∶1∶1∶4
即该蛭石矿的组成为8 MgO·Al2O3·Fe2O3·4SiO2。

 阅读快车系列答案
阅读快车系列答案