题目内容
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对反应A2(g)+3B2(g)![]() 2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是
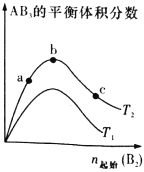
A.正反应一定是放热反应
B.若T2>T1,则正反应一定是吸热反应
C.达到平衡时A2的转化率大小为:b>a>c
D.b点时,平衡体系中A、B原子数之比接近3:1
【答案】B
【解析】
试题分析:A、由于不知道T2与T1的大小关系,所以不能判断反应时吸热还是放热,A错误;C、若T2>T1,温度越高,平衡时AB3含量越多,平衡正移,则正反应是吸热反应,B正确;C、曲线先增加,原因是加入气体B2时,平衡正向移动。然后曲线再降低,原因是通入的气体量大,总气体体积增大显著。使得AB3的体积分数减小,实际上平衡仍旧在向正向移动,所以转化率比较应该是c>b>a,C错误;D、b点时,平衡体系中A、B原子数之比接近1∶3,D错误,答案选B。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目