题目内容
18.下列化学用语表达正确的是( )| A. | 氮原子基态时电子排布式:1S22S22P3 | |
| B. | 右图为氮原子基态时的轨道表示式: | |
| C. | S2-电子排布式:1s22s22p63s23p4 | |
| D. | 29Cu原子基态排布式:[Ar]3d94s2 |
分析 A.氮原子为7号元素,原子核外有7个电子;
B.N原子核外有7个电子,分别位于1S、2S、2P轨道,应遵循保利原理和洪特规则即2p轨道3个电子自旋方向相同;
C.S原子为16号元素,S2-核外有18个电子;
D.Cu为29号元素,原子核外有29个电子,处于全满和半满的稳定结构;
解答 解:A.氮原子为7号元素,原子核外有7个电子,其核外电子排布式为:1s22s22p3,故A正确;
B.N原子核外有7个电子,分别位于1S、2S、2P轨道,应遵循保利原理和洪特规则即2p轨道3个电子自旋方向相同,其轨道表示式为 ,故B错误;
,故B错误;
C.S原子为16号元素,S2-核外有18个电子,其核外电子排布式为:1s22s22p63s23p6,故C错误;
D.Cu为29号元素,原子核外有29个电子,根据能量最低原理,处于全满和半满的稳定结构,其核外电子排布式为:1s22s22p63s23p63d104s1,故D错误;
故选:A.
点评 本题考查了原子的电子排布图以及电子排布式,明确相关化学用语的表示方法是解题关键,题目难度不大.

练习册系列答案
相关题目
8.下列分散系中.分散质粒+直径最小的是( )
| A. | KC1 溶液 | B. | Fe (OH)3胶体 | C. | 牛奶 | D. | 石灰乳 |
6.常温下,分别将四块形状相同,质量均为7g的铁块同时投入下列四种溶液中,铁块首先溶解完的是( )
| A. | 20.0 mL 18 mol•L-1 H2SO4溶液 | B. | 250.0 mL 2 mol•L-1 HCl溶液 | ||
| C. | 150.0 mL 2 mol•L-1 H2SO4溶液 | D. | 500.0 mL 3 mol•L-1 HCl溶液 |
13.常温下,向100mL0.05mol/L氢硫酸中逐渐通入氯气.下列叙述正确的是( )
| A. | 溶液c(H+)先变大后变小 | |
| B. | 溶液导电能力逐渐增强 | |
| C. | 氢硫酸完全反应生成1.6g硫 | |
| D. | 反应的离子方程式为:S2-+Cl2→2Cl-+S↓ |
3.下列关于有机化合物的叙述说法不正确的是( )
| A. | 等质量的A、B两种烃分别完全燃烧后,生成的CO2与消耗的O2的物质的量均相同,则A和B一定互为同系物 | |
| B. | 沸点比较:正戊烷>异戊烷>新戊烷 | |
| C. | 邻二甲苯只有一种结构可以作为判断苯分子中不存在碳碳单键与碳碳双键的交替结构 | |
| D. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 |
10.类比推理是化学中常用的思维方法.下列推理正确的是( )
| A. | 卤素单质的熔沸点随原子序数增大而升高,所以碱金属单质熔沸点也随原子序数增大而升高 | |
| B. | Na能与冷水反应,推测Cs也能与冷水反应 | |
| C. | Fe与Cl2反应生成FeCl3,推测Fe与S反应生成Fe2S3 | |
| D. | CO2不能与Ba(NO3)2反应,所以SO2也不能与 Ba(NO3)2反应 |
7.碳酸锶( SrCO3)可、作磁、材料、电子元件和焰火材料等.以天青石(主要成分为SrSO4,含有少量BaCO3.FeO.Fe2O3、Al2O3、SiO2等)为原料制备SrCO3的工艺流程如图1:

已知:
回答下列问题:
(I)写出一条能加快“浸取转化”反应速率的措施:升高温度增大纯碱浓度;滤液1的主要成分为Na2SO4(填化学式).
(2)加入HC1、HNO3混酸溶解后,所得溶液中阳离子共有5种;滤渣1的主要成分为SiO2(填化学式).
(3)“除钡”过程中硫酸过多会导致锶元素的损失.若除钡后所得溶液(M)中c(Ba2+)=1.0×10-5mol•L-1,要使锶元素不损失,则M中c(Sr2+)应不超过0.029mol•L-1(计算结果保留2位有效数字).
(4)“沉锶”生成SrCO3的离子方程式为Sr2++2HCO3-=SrCO3+H2O+CO2↑.“沉锶”过程中锶的转化率随温度变化如图2所示,60℃之前,锶的转化率随温度升高而变大的主要原因是升温有利于二氧化碳逸出有利于SrCO3生成.
(5)以SrCO3粉作原料经高温焙烧分解成SrO,再将SrO与铝粉充分混合并压制,真空环境下通过热还原反应可制得金属Sr,同时获得3SrO•Al2O3渣团.请写出热还原反应的化学方程式6SrO+2Al$\frac{\underline{\;高温\;}}{\;}$2Sr+3SrO•Al2O3.

已知:
| SrSO4 | BaSO4 | SrCO3 | |
| Ksp | 3.2×10-7 | 1.1×10-10 | 1.6×10-10 |
(I)写出一条能加快“浸取转化”反应速率的措施:升高温度增大纯碱浓度;滤液1的主要成分为Na2SO4(填化学式).
(2)加入HC1、HNO3混酸溶解后,所得溶液中阳离子共有5种;滤渣1的主要成分为SiO2(填化学式).
(3)“除钡”过程中硫酸过多会导致锶元素的损失.若除钡后所得溶液(M)中c(Ba2+)=1.0×10-5mol•L-1,要使锶元素不损失,则M中c(Sr2+)应不超过0.029mol•L-1(计算结果保留2位有效数字).
(4)“沉锶”生成SrCO3的离子方程式为Sr2++2HCO3-=SrCO3+H2O+CO2↑.“沉锶”过程中锶的转化率随温度变化如图2所示,60℃之前,锶的转化率随温度升高而变大的主要原因是升温有利于二氧化碳逸出有利于SrCO3生成.
(5)以SrCO3粉作原料经高温焙烧分解成SrO,再将SrO与铝粉充分混合并压制,真空环境下通过热还原反应可制得金属Sr,同时获得3SrO•Al2O3渣团.请写出热还原反应的化学方程式6SrO+2Al$\frac{\underline{\;高温\;}}{\;}$2Sr+3SrO•Al2O3.
8.下列各对物质中属于同分异构体的是( )
| A. | ${\;}_{6}^{12}$C与${\;}_{6}^{13}$ C | B. | CH4与CH3CH2CH3 | ||
| C. |  | D. |  |
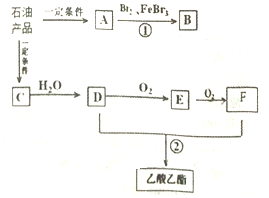 石油是一种重要的资源,其常压蒸馏的产品在一定条件下能转化为芳香烃.A-F均为有机化合物,C的产量可以用来衡量一个国家的石油化工发展水平.它们的转化关系如图所示(部分产物和反应条件已略去).
石油是一种重要的资源,其常压蒸馏的产品在一定条件下能转化为芳香烃.A-F均为有机化合物,C的产量可以用来衡量一个国家的石油化工发展水平.它们的转化关系如图所示(部分产物和反应条件已略去). ,反应类型为取代反应;
,反应类型为取代反应;