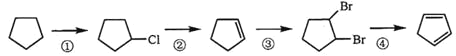
题目内容
【题目】原子序数依次增大的短周期主族元素X、Y、Z、W、R,其中X、Y两种元素的核电荷数之差等于它们的原子最外层电子数之和;Y、Z位于相邻主族;Z是地壳中含量最高的元素;X、W是同主族元素。上述五种元素两两间能形成四种常见的化合物甲、乙、丙、丁,这四种化合物中原子个数比如下表:
甲 | 乙 | 丙 | 丁 | |
化合物中各元素原子个数比 |
|
|
|
|
(1)写出下列元素符号:Y_____________,Z_______________,W_____________,R________________。
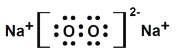
(2)写出下列化合物的电子式:乙_______________,丙__________________。
(3)向甲的水溶液中加入丁,有淡黄色沉淀生成,请写出反应的化学方程式:__________________。
(4)甲和乙反应能放出大量的热,同时生成两种无污染的物质,请写出该反应的化学方程式:______________________________。
【答案】N O Na S 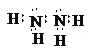
 H2O2+Na2S=2NaOH+S↓ N2H4+2H2O2=N2+4H2O
H2O2+Na2S=2NaOH+S↓ N2H4+2H2O2=N2+4H2O
【解析】
根据题目,X、Y、Z、W、R五种短周期元素,原子序数依次递增,Z为地壳中含量最多的元素,故Z为O元素;Y、Z位于相邻主族,则Y为N元素;X、Y两种元素的核电荷数之差等于它们的原子最外层电子数之和,设X元素的原子序数为x,则该原子的最外层电子数为x或x-2,当最外层电子数为x时,根据题目x+5=7-x,解得x=1,当最外层电子数为x-2时,根据题目,x-2+5=7-x,x=2,但题目要求X为主族元素,故X元素为H元素;X、W是同主族元素,则W为Na元素;根据表格,H和O两种元素形成原子个数比为1:1的化合物,则甲为H2O2,N和H两种元素形成原子个数比为1:2的化合物,则乙为N2H4,Na和O两种元素形成原子个数比为1:1的化合物,则丙为Na2O2,Na和R元素形成原子个数比为2:1的化合物,可以推断该化合物为Na2S,则R元素为S元素,据此答题。
(1)Y的元素符号为N,Z的元素符号为O,W的元素符号为Na,R的元素符号为S;
(2)乙物质的电子式为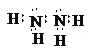 ,丙物质的电子式为
,丙物质的电子式为 ;
;
(3)向过氧化氢溶液中加入硫化钠,出现淡黄色沉淀,该沉淀为S沉淀,反应方程式为:H2O2+Na2S=2NaOH+S↓;
(4)过氧化氢和N2H4发生反应生成两种无污染的物质,这两种物质为N2和H2O,则反应方程式为:N2H4+2H2O2=N2+4H2O。

 轻松夺冠全能掌控卷系列答案
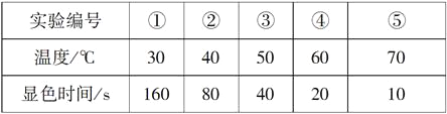
轻松夺冠全能掌控卷系列答案【题目】利用下图所示装置进行下列实验,其中丙中实验现象描述正确的是

实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
A | 浓硫酸 | 亚硫酸钠 | 紫色石蕊试液 | 溶液先变红后褪色 |
B | 浓盐酸 | 高锰酸钾 | 淀粉碘化钾溶液 | 溶液会变蓝 |
C | 稀盐酸 | 碳酸钙 | 氯化钡溶液 | 有白色沉淀生成 |
D | 浓氨水 | 氧化钙 | 氯化铝溶液 | 先生成白色沉淀然后沉淀溶解 |
A. A B. B C. C D. D