题目内容
用惰性电极电解NaCl和CuSO4混合液250mL,经过一段时间后,两极均得到11.2L气体( STP),则下列有关描述中,正确的是( )
分析:惰性电极电解NaCl和CuSO4混合液,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,阳极发生2Cl--2e-=Cl2↑、40H--4e-═2H2O+O2↑,结合两极均得到11.2L气体( STP),来解答.
解答:解:惰性电极电解NaCl和CuSO4混合液,两极均得到11.2L气体,则阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,阳极发生2Cl--2e-=Cl2↑、40H--4e-═2H2O+O2↑,
A.阳极发生2Cl--2e-=Cl2↑、40H--4e-═2H2O+O2↑,故A错误;
B.阴极只有氢气,故B错误;
C.两极均得到11.2L气体,则n(H2)=0.5mol,电解时先发生Cu2++2e-=Cu、2Cl--2e-=Cl2↑,则n(Cl2)=n(O2)=0.25mol,所以c(C1-)起始为2 mol?L-1,转移电子共1.5mol,由
0.5mol电子转移时参加反应的Cu2+为0.25mol,所以Cu2+起始浓度为
=l mol?L-l,故C正确;
D.由C分析可知Cu2+的起始物质的量为0.25mol,小于0.5mol,故D错误;
故选C.
A.阳极发生2Cl--2e-=Cl2↑、40H--4e-═2H2O+O2↑,故A错误;
B.阴极只有氢气,故B错误;
C.两极均得到11.2L气体,则n(H2)=0.5mol,电解时先发生Cu2++2e-=Cu、2Cl--2e-=Cl2↑,则n(Cl2)=n(O2)=0.25mol,所以c(C1-)起始为2 mol?L-1,转移电子共1.5mol,由
0.5mol电子转移时参加反应的Cu2+为0.25mol,所以Cu2+起始浓度为
| 0.25mol |
| 0.25L |
D.由C分析可知Cu2+的起始物质的量为0.25mol,小于0.5mol,故D错误;
故选C.
点评:本题考查电解原理,明确惰性电极电解时离子的放电顺序及发生的电极反应是解答本题的关键,选项C为解答的难点,注意转移的电子守恒来解答,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


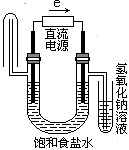 B、
B、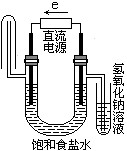
 D、
D、