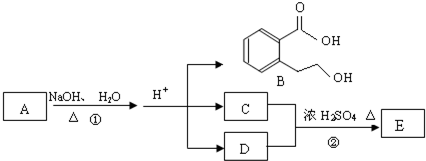
题目内容
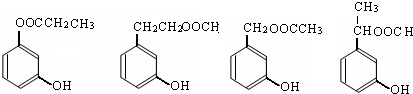
下列四种有机化合物均含有多个官能团,其结构简式如图所示,下面有关说法中正确的是( )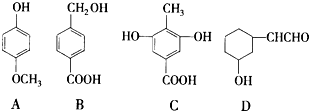

分析:A.酚-OH不能与NaHCO3溶液反应;
B.B中不含酚-OH;
C.酚-OH的邻、对位能与溴发生取代反应;
D.-OH与烃基相连,且与-OH相连的C原子的邻位C原子上含H.
B.B中不含酚-OH;
C.酚-OH的邻、对位能与溴发生取代反应;
D.-OH与烃基相连,且与-OH相连的C原子的邻位C原子上含H.
解答:解:A.酚-OH不能与NaHCO3溶液反应,则A属于酚类,不与NaHCO3溶液反应产生CO2,故A错误;
B.B中不含酚-OH,所以不能使FeCl3溶液显紫色,故B错误;
C.酚-OH的邻、对位能与溴发生取代反应,所以1 molC最多能与2mol Br2发生反应,故C错误;
D.-OH与烃基相连,属于醇,且与-OH相连的C原子的邻位C原子上含H,能发生消去反应,故D正确;
故选D.
B.B中不含酚-OH,所以不能使FeCl3溶液显紫色,故B错误;
C.酚-OH的邻、对位能与溴发生取代反应,所以1 molC最多能与2mol Br2发生反应,故C错误;
D.-OH与烃基相连,属于醇,且与-OH相连的C原子的邻位C原子上含H,能发生消去反应,故D正确;
故选D.
点评:本题考查有机物的结构与性质,注意-OH与苯环直接相连的有机物属于酚,明确酚的性质是解答的关键,题目难度不大.

练习册系列答案
相关题目
在下列四种有机化合物中,分子内所有原子均在同一平面的是( )
| A、丙烯 | B、氯乙烯 | C、苯 | D、甲苯 |