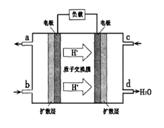
题目内容
下列有关热化学方程式的叙述中,正确的是 ( )
| A.含20.0g NaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中[和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.8kJ/mol |
B.已知热化学方程式:SO2(g)+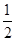 O2(g) O2(g) SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ |
| C.已知2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol |
| D.已知①S(s)+O2(g)=SO2(g); △H1②S(g)十O2(g)=SO2(g);△H2 则△H1>△H2 |
D
试题分析:A.中[和热是酸碱发生中和反应产生1摩尔的水时放出的热量。表示中[和热的热化学方程式为NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l) △H=-57.4kJ/mol .B该反应是可逆反应,不能进行到底,所以.在容器中充入2molSO2和1molO2充分反应,不能完全反应。最终放出的热量小于196.64kJ。错误。C.燃烧热是1摩尔的物质完全燃烧产生稳定的氧化物时所放出的热量。水在气态时不稳定。错误。D.物质在气态时含有的能量比液态时要多,所以产生相同状态的产物时放热气态比液态多。正确。

练习册系列答案
相关题目
 H2SO4(aq)+
H2SO4(aq)+ 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量