题目内容
下列实验操作会导致实验结果偏低的是
(1)配制100g10%的CuSO4溶液,称取10g胆矾晶体溶于90g水中
(2)配制一定物质的量的浓度的H2SO4溶液,浓硫酸溶解后未冷却就立即转移入容量瓶进行定容
(3)配制一定物质的量的浓度的H2SO4溶液,定容时仰视容量瓶的刻度线
(4)实验室制取氯气,当二氧化锰足量且反应充分,利用收集到的氯气的物质的量求算出的浓盐酸中溶质的物质的量.
- A.只有(1)
- B.只有(2)
- C.(2)(3)(4)
- D.(1)(3)(4
D
分析:(1)计算10硫酸铜晶体中含有的硫酸铜的质量,再根据溶质质量分数=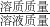 ×100%计算硫酸铜溶液的质量分数,据此判断;
×100%计算硫酸铜溶液的质量分数,据此判断;
(2)浓硫酸溶解放出大量的热,未冷却就立即转移入容量瓶进行定容,冷却后溶液的体积偏小,结合c= 判断;
判断;
(3)定容时仰视容量瓶的刻度线,溶液凹液面在刻度线以上,溶液的体积偏大,结合c= 判断;
判断;
(4)二氧化锰与浓盐酸反应,不稀盐酸反应,随反应进行浓盐酸变为稀盐酸,HCl不能完全反应.
解答:(1)10硫酸铜晶体中含有的硫酸铜的质量为10g×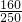 =6.4g,故该硫酸铜溶液的质量分数为
=6.4g,故该硫酸铜溶液的质量分数为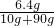 ×100%=6.4%,故所配溶液浓度偏低;
×100%=6.4%,故所配溶液浓度偏低;
(2)浓硫酸溶解放出大量的热,未冷却就立即转移入容量瓶进行定容,冷却后溶液的体积偏小,结合c= 可知所配溶液的偏高;
可知所配溶液的偏高;
(3)定容时仰视容量瓶的刻度线,溶液凹液面在刻度线以上,溶液的体积偏大,结合c= 可知所配溶液的浓度偏低;
可知所配溶液的浓度偏低;
(4)二氧化锰与浓盐酸反应,不稀盐酸反应,随反应进行浓盐酸变为稀盐酸,HCl不能完全反应,故利用收集到的氯气的物质的量求算盐酸中HCl的物质的量,导致HCl的物质的量偏低;
故选D.
点评:考查一定物质的量浓度溶液配制及一定质量分数溶液的配制误差分析等,难度不大,清楚溶液配制原理是关键.
分析:(1)计算10硫酸铜晶体中含有的硫酸铜的质量,再根据溶质质量分数=
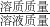 ×100%计算硫酸铜溶液的质量分数,据此判断;
×100%计算硫酸铜溶液的质量分数,据此判断;(2)浓硫酸溶解放出大量的热,未冷却就立即转移入容量瓶进行定容,冷却后溶液的体积偏小,结合c=
 判断;
判断;(3)定容时仰视容量瓶的刻度线,溶液凹液面在刻度线以上,溶液的体积偏大,结合c=
 判断;
判断;(4)二氧化锰与浓盐酸反应,不稀盐酸反应,随反应进行浓盐酸变为稀盐酸,HCl不能完全反应.
解答:(1)10硫酸铜晶体中含有的硫酸铜的质量为10g×
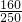 =6.4g,故该硫酸铜溶液的质量分数为
=6.4g,故该硫酸铜溶液的质量分数为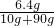 ×100%=6.4%,故所配溶液浓度偏低;
×100%=6.4%,故所配溶液浓度偏低;(2)浓硫酸溶解放出大量的热,未冷却就立即转移入容量瓶进行定容,冷却后溶液的体积偏小,结合c=
 可知所配溶液的偏高;
可知所配溶液的偏高;(3)定容时仰视容量瓶的刻度线,溶液凹液面在刻度线以上,溶液的体积偏大,结合c=
 可知所配溶液的浓度偏低;
可知所配溶液的浓度偏低;(4)二氧化锰与浓盐酸反应,不稀盐酸反应,随反应进行浓盐酸变为稀盐酸,HCl不能完全反应,故利用收集到的氯气的物质的量求算盐酸中HCl的物质的量,导致HCl的物质的量偏低;
故选D.
点评:考查一定物质的量浓度溶液配制及一定质量分数溶液的配制误差分析等,难度不大,清楚溶液配制原理是关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目