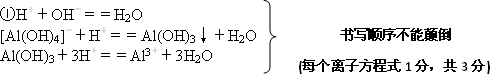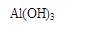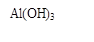题目内容
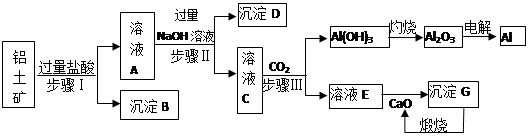
铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料.提取氧化铝的工艺流程如下:
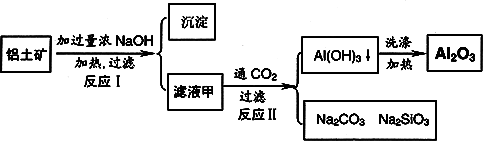
(1)滤液甲的主要成分是(写化学式)________
(2)写出反应Ⅱ的离子方程式:________
(3)结合反应Ⅱ,判断下列微粒结合质子(H+)的能力,由强到弱的顺序是________(填字母序号)
a.AlO2―或[Al(OH)4]-
b.OH―
c.SiO32―
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失.沉淀消失的原因可用离子方程式表示为:________
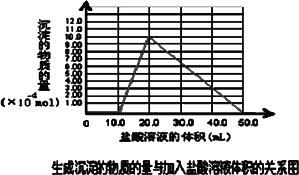
(5)取(4)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol·L-1盐酸溶液,当加入50.0 mL盐酸溶液时,生成的沉淀恰好溶解.
①加入50.0 mL盐酸溶液发生的离子反应的先后顺序依次为:________.
②请画出生成沉淀的物质的量与加入盐酸体积的关系图.
解析:
|
(1)NaOH、Na[Al(OH)4](或NaAlO2)、Na2SiO3(漏1个扣1分,2分) (2)CO2+2OH- CO2+2[Al(OH)4]- (3)b>a>c (2分) (4)Al(OH)3+OH-=[Al(OH)4]-或Al(OH)3+OH-=AlO2-+2H2O (2分) (5) ②、图像如下所表示.(每作出正确一段线段得1分,共3分)
|

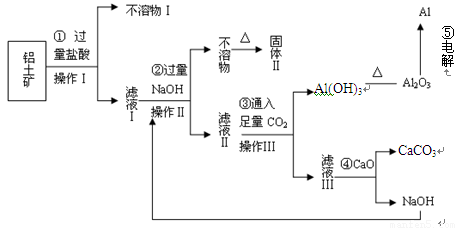
(12分)电解铝技术的出现与成熟让铝从皇家珍品变成汽车、轮船、航天航空制造、化工生产等行业的重要材料。工业上用铝土矿(主要成分为Al2O3,Fe2O3、SiO2等)提取纯Al2O3做冶炼铝的原料,某研究性学习小组设计了如下提取流程图
![]()
|
|
(1)固体Ⅱ的化学式为_ ▲ ,该固体的颜色为 ▲ ;
(2)在实际工业生产流程⑤中需加入冰晶石,目的是 ▲ ;
(3)写出流程③的离子方程式 ▲ ;
(4)铝粉与氧化铁粉末在引燃条件下常用来焊接钢轨,主要是利用该反应 ▲ ;
(5)从铝土矿中提取铝的过程不涉及的化学反应类型是 ▲ ;
A.复分解反应 B.氧化还原反应 C.置换反应 D.分解反应
(6)生产过程中除NaOH、H2O可以循环使用外,还可以循环使用的物质有_ ▲ _;
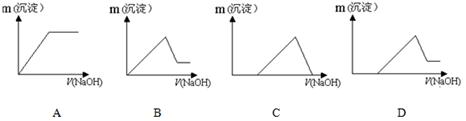
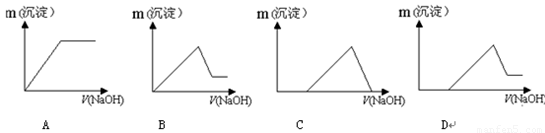
(7)若向滤液Ⅰ中逐滴滴入NaOH溶液至过量,产生沉淀随NaOH滴入关系正确的是
(12分)电解铝技术的出现与成熟让铝从皇家珍品变成汽车、轮船、航天航空制造、化工生产等行业的重要材料。工业上用铝土矿(主要成分为Al2O3,Fe2O3、SiO2等)提取纯Al2O3做冶炼铝的原料,某研究性学习小组设计了如下提取流程图
|
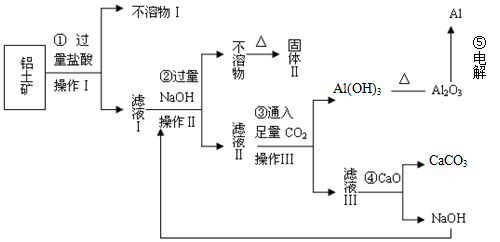 (1)固体Ⅱ的化学式为_ ,该固体的颜色为 ;
(1)固体Ⅱ的化学式为_ ,该固体的颜色为 ;(2)在实际工业生产流程⑤中需加入冰晶石,目的是 ;
(3)写出流程③的离子方程式 ;
(4)铝粉与氧化铁粉末在引燃条件下常用来焊接钢轨,主要是利用该反应 ;
(5)从铝土矿中提取铝的过程不涉及的化学反应类型是 ;
A.复分解反应 B.氧化还原反应 C.置换反应 D.分解反应
(6)生产过程中除NaOH、H2O可以循环使用外,还可以循环使用的物质有_ _;
(7)若向滤液Ⅰ中逐滴滴入NaOH溶液至过量,产生沉淀随NaOH滴入关系正确的是