��Ŀ����
����Ŀ��ʵ���ҴӺ����Һ����H2O�⣬����CCl4��I2��I���ȣ��л��յ⣬��ʵ��������£�
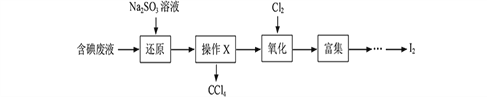
��1�����Һ�м����Թ�����Na2SO3��Һ������Һ�е�I2��ԭΪI���������ӷ���ʽΪ________________���ò�����I2��ԭΪI����Ŀ����_____________________��
��2������X������Ϊ____________��
��3������ʱ��������ƿ�н���I����ˮ��Һ���������pHԼΪ2������ͨ��Cl2����400C���ҷ�Ӧ��ʵ��װ������ͼ��ʾ����ʵ������ڽϵ��¶��½��е�ԭ����________________����ƿ��ʢ�ŵ���ҺΪ______________��

��4����֪��5SO32��+2IO3��+2H��![]() I2+5SO42��+H2O
I2+5SO42��+H2O
ij�����ˮ��pHԼΪ8����һ������I2�����ܴ���I����IO3���е�һ�ֻ����֡��벹���������麬���ˮ���Ƿ���IO3����ʵ�鷽����ʵ���пɹ�ѡ����Լ���ϡ���ᡢ������Һ��FeCl3��Һ��Na2SO3��Һ��ȡ���������ˮ��CCl4�����ȡ����Һ��ֱ��ˮ���õ�����Һ���鲻���ⵥ�ʴ��ڣ�_____________________________________________________________
���𰸡� SO32�� + I2 + H2O = 2I�� + SO42�� + 2H�� ʹCCl4�еĵ����ˮ�� ��Һ ʹ��������Һ���нϴ���ܽ�ȣ���ֹI2��������ֹI2��һ����������������1�㼴�ɣ� NaOH��Һ ��ˮ����ȡ������Һ������1��2mL������Һ���������ữ���μ�Na2SO3��Һ������Һ����������IO3-
�����������⿼�黯ѧ�������̣���1������������ԭ��Ӧ����ʽ����д��I2����ԭ��I������SO32����������SO42������SO32����I2��SO42����I����SO32���л��ϼ��ɣ�4�ۡ���6�ۣ����ϼ�����2�ۣ�I2��I���ϼ���0�ۡ���1�ۣ�������2�ۣ����ӷ���ʽǰ�������������ȣ���SO32����I2��H2O=2I����SO42����2H�����ⵥ���������л��ܼ�����������ͼ��ʹCCl4�еĵ����ˮ�㣻��2��CCl4���ڲ����ڵ��л����״̬��Һ�壬��˲���XΪ��Һ����3��ʹ��������Һ���нϴ���ܽ�ȣ�������������ã��ⵥ����������������ֹI2��������4����Ϊ�����ж���Ϊ��ֹ��Ⱦ����������β����������������һ����NaOH��Һ�������ƿ��ʢ��NaOH��Һ����4������IO3������Ҫת����I2������IO3���������ԣ���˼���Na2SO3��Һ���õ��ۼ��飬�����Һ����ɫ��˵������IO3������������ǣ���ˮ����ȡ������Һ������1��2mL������Һ���������ữ���μ�Na2SO3��Һ������Һ����������IO3����

 �����Ļ������������������ϵ�д�
�����Ļ������������������ϵ�д�

