题目内容
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。通过对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
(1)反应2NO2(g) ![]() N2(g)+2O2(g),设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。
N2(g)+2O2(g),设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。

则A点时,NO2的转化率为_______________,B点时,设容器的总压为a Pa,则平衡常数Kp为____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下,下列反应能自发进行:CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g)。
CH3OH(g) +H2O(g)。
①该反应ΔH_______0(填“>”、“<”或“=”)
②下列叙述能说明此反应达到平衡状态的是____________。(填字母)
a.混合气体的平均相对分子质量保持不变
b.1 mol CO2生成的同时有3 mol H—H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
③ 反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
反应时间 | CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
反应Ⅰ:恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应Ⅱ:绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
反应Ⅰ,前10min内的平均反应速率v(CH3OH)=_______________________________。达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)____________K(II)(填“>”、“<”或“=”);平衡时CH3OH的浓度c(I)____________c(II)(填“>”、“<”或“=”)。
【答案】50% a Pa<ab0.025 mol·L-1 ·min-1>>
【解析】
(1)根据化学方程式2NO2(g) ![]() N2(g)+2O2(g)及图示数据,A点时NO2是10mol,O2是10mol,N2是5mol,所以NO2初始物质的量是20mol,则NO2的转化率为
N2(g)+2O2(g)及图示数据,A点时NO2是10mol,O2是10mol,N2是5mol,所以NO2初始物质的量是20mol,则NO2的转化率为![]() 50%;B点时NO2和N2物质的量相等,设为xmol,则O2是2xmol,因为容器的总压为a Pa,所以NO2和N2的分压都是
50%;B点时NO2和N2物质的量相等,设为xmol,则O2是2xmol,因为容器的总压为a Pa,所以NO2和N2的分压都是![]() a Pa,O2的分压是
a Pa,O2的分压是![]() a Pa,则平衡常数Kp=
a Pa,则平衡常数Kp=![]() =
= 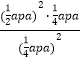 =aPa;(2)①由方程式可看出该反应S<0,因为反应能自发进行,所以H-TS<0,则H<0;②a、混合气体的平均相对分子质量=气体总质量÷物质的量,该反应的反应物和生成物都是气体,物质的量变化,根据质量守恒定律,所以混合气体的平均相对分子质量变化,则当混合气体的平均相对分子质量保持不变时,达到了平衡状态,故a正确;b、1molCO2生成同时有3molH-H键断裂,即消耗3molH2,根据化学反应方程式,能说明正逆反应速率相等,则达到了平衡状态,故b正确;c、开始充入2molCO2和6molH2,投料比等于化学方程式系数比,CO2和H2的转化率始终相等,不能说明正逆反应速率相等,不一定达到平衡状态,故c错误;d、混合气体的密度等于气体质量和体积的比值,反应前后质量守恒,体积不变,所以密度始终不变,密度保持不变时不一定是平衡状态,故d错误。答案选ab;③由表中数据可知,反应Ⅰ前10min内反应的H2为:(6-4.5)mol=1.5mol,根据化学方程式可得,生成CH3OH为:
=aPa;(2)①由方程式可看出该反应S<0,因为反应能自发进行,所以H-TS<0,则H<0;②a、混合气体的平均相对分子质量=气体总质量÷物质的量,该反应的反应物和生成物都是气体,物质的量变化,根据质量守恒定律,所以混合气体的平均相对分子质量变化,则当混合气体的平均相对分子质量保持不变时,达到了平衡状态,故a正确;b、1molCO2生成同时有3molH-H键断裂,即消耗3molH2,根据化学反应方程式,能说明正逆反应速率相等,则达到了平衡状态,故b正确;c、开始充入2molCO2和6molH2,投料比等于化学方程式系数比,CO2和H2的转化率始终相等,不能说明正逆反应速率相等,不一定达到平衡状态,故c错误;d、混合气体的密度等于气体质量和体积的比值,反应前后质量守恒,体积不变,所以密度始终不变,密度保持不变时不一定是平衡状态,故d错误。答案选ab;③由表中数据可知,反应Ⅰ前10min内反应的H2为:(6-4.5)mol=1.5mol,根据化学方程式可得,生成CH3OH为:![]() =0.5mol,前10min内的平均反应速率v(CH3OH)=
=0.5mol,前10min内的平均反应速率v(CH3OH)=![]() =0.025 molL-1min-1;前面已知该反应H<0,为放热反应,又因为反应Ⅰ为恒温恒容条件,反应Ⅱ为绝热恒容条件,所以反应Ⅱ相当于升温,化学平衡常数减小,故K(I)>K(II);反应Ⅱ中若把CH3OH和H2O(g)的初始物质的量全部转化为CO2和H2,与反应Ⅰ初始物质的量对应相等,但反应Ⅱ温度高于反应Ⅰ,所以反应Ⅱ相当于在和反应Ⅰ等效的基础上又升高温度,平衡逆向移动,故平衡时CH3OH的浓度c(I)>c(II)。
=0.025 molL-1min-1;前面已知该反应H<0,为放热反应,又因为反应Ⅰ为恒温恒容条件,反应Ⅱ为绝热恒容条件,所以反应Ⅱ相当于升温,化学平衡常数减小,故K(I)>K(II);反应Ⅱ中若把CH3OH和H2O(g)的初始物质的量全部转化为CO2和H2,与反应Ⅰ初始物质的量对应相等,但反应Ⅱ温度高于反应Ⅰ,所以反应Ⅱ相当于在和反应Ⅰ等效的基础上又升高温度,平衡逆向移动,故平衡时CH3OH的浓度c(I)>c(II)。

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案