题目内容
20.根据要求回答下列问题(1)已知NaHSO3水溶液显酸性,原因HSO3-?H++SO32-,HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度(用离子方程式和文字叙述表示)
(2)在干燥的HCl气流中加热MgCl2•6H2O时,能得到无水MgCl2,其原因是Mg2++2H2O?Mg(OH)2+2H+,在干燥的HCl气流中可以抑制Mg2+的水解
(3)用标准酸性KMnO4溶液测定某补血口服液中Fe2+的含量时,酸性KMnO4溶液应放在酸式 滴定管中,判断滴定终点的方法当滴加最后一滴酸性KMnO4溶液时,锥形瓶内的溶液恰好由紫红色变为无色,且半分钟内不恢复
(4)AgCl悬浊液中加入Na2S溶液,白色沉淀转化为黑色沉淀,其原因是2AgCl+S2-?Ag2S+2Cl-(用离子方程式表示)
(5)已知Cl2和H2O通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)△H=-290.0 kJ•mol-1.
分析 (1)亚硫酸氢钠是强碱弱酸盐,溶液显酸性,说明亚硫酸氢根离子电离程度大于其水解程度;
(2)氯化镁水解显酸性,氯化氢气流中加热防止水解;
(3)高锰酸钾溶液具有强氧化性,滴定实验应放在酸式滴定管中;高锰酸钾溶液呈紫红色,依据滴入溶液颜色变化判断反应终点;
(4)根据溶解度大的沉淀向溶解度小的沉淀的方向转变,沉淀溶解平衡向离子浓度减小的方向移动;
(5)根据热化学方程式的含义和书写方法来回答.
解答 解:(1)NaHSO3水溶液中存在电离平衡和水解平衡HSO3-?H++SO32-,HSO3-+H2O?H2SO3+OH-,溶液显酸性说明HSO3-的电离程度大于水解程度,
故答案为:HSO3-?H++SO32-,HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度;
(2)氯化镁水解显酸性,Mg2++2H2O?Mg(OH)2+2H+,氯化氢气流中加热防止水解,HCl气流可抑制Mg2+水解;
故答案为:Mg2++2H2O?Mg(OH)2+2H+,在干燥的HCl气流中可以抑制Mg2+的水解;
(3)用标准酸性KMnO4溶液测定某补血口服液中Fe2+的含量时,酸性KMnO4溶液具有强氧化应放在酸式滴定管中,判断滴定终点的方法当滴加最后一滴酸性KMnO4溶液时,锥形瓶内的溶液恰好由紫红色变为无色,且半分钟内不恢复,
故答案为:酸式;当滴加最后一滴酸性KMnO4溶液时,锥形瓶内的溶液恰好由紫红色变为无色,且半分钟内不恢复;
(4)因为Ag2S的溶解度比AgCl的溶解度小,所以发生反应:2AgCl+Na2S=Ag2S+2NaCl,故答案为:2AgCl+S2-?Ag2S+2Cl-;
(5)1molCl2参与反应时释放出145KJ热量,则反应2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)会放出290KJ的能量,即2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)△H=-290.0 kJ•mol-1,
故答案为:2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)△H=-290.0 kJ•mol-1.
点评 本题考查了盐类水解的分析,滴定实验的注意问题,沉淀转化原理,热化学方程式书写,掌握基础是解题关键,题目难度中等.

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案| A. | 该溶液中一定含硫酸根离子 | |
| B. | 该溶液中一定含有银离子 | |
| C. | 该溶液中一定含有硫酸根离子和银离子 | |
| D. | 该溶液中可能含有硫酸根离子或银离子 |
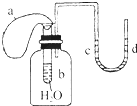 如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的.将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将不会出现的现象是( )
如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的.将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将不会出现的现象是( )| A. | 气球a被吹大 | B. | 试管b内有气泡冒出 | ||
| C. | U形管内红色褪去 | D. | U形管水位d高于c |
| A. | 2mol | B. | 3mol | C. | 4mol | D. | 5mol |
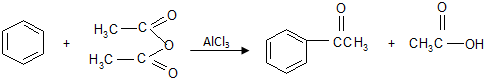
主要实验方法如下:取一定量的乙酸酐、无水苯和无水AlCl3混合反应,加热回流1小时.反应结束后,按如下的流程分离和提纯.
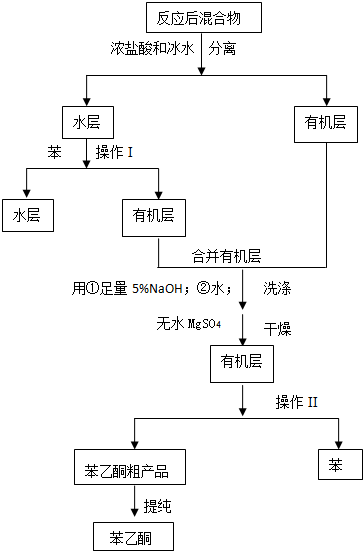
已知:
| 物质 | 苯乙酮 | 苯 | 乙酸 | 水 |
| 沸点℃ | 202 | 80 | 118 | 100 |
(2)操作Ⅰ为萃取、分液;操作Ⅱ为蒸馏.
(3)操作Ⅰ操作中是否可改用乙醇萃取?否(填“是”或“否”),原因是乙醇与水互溶.
(4)苯乙酮的粗产品中是否含有乙酸?否(填“是”或“否”),原因是在洗涤的操作中,足量5%的氢氧化钠已将乙酸完全中和,进入水层.
(5)若苯乙酮的粗产品中含有低沸点的杂质苯和水,请设计实验方案进行提纯将苯乙酮粗产品进行蒸馏,迅速将温度升高到202℃,收集馏分.
(1)请完成下表:
| 甲同学 | 乙同学 | |
| 选用试剂 | A1C13溶液、NaOH溶液 | A12(SO4)3溶液、氨水 |
| 操作 | 向AlCl3溶液中逐滴加入NaOH溶液至过量 | 向A12(SO4)3溶液中逐滴加入氨水至过量 |
| 实验现象 | 先产生白色沉淀,然后沉淀逐渐消失 | |
| 化学方程式 | AlCl3+3NaOH=Al(OH)3↓+3NaClAl(OH)3+NaOH=NaAlO2+2H2O | A12(SO4)3+6NH3•H2O═2A1(OH)3↓+3(NH4)2SO4 |
| 离子方程式 | Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O | Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
(3)由甲、乙两同学的实验现象你能得出的结论有(用简要文字说明)实验室制取氢氧化铝最好选用可溶性铝盐和氨水,氢氧化铝可以和氢氧化钠溶液发生反应,和一水合氨不发生反应.
| A. | 10 | B. | 3 | C. | 9 | D. | 6 |
 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视. .
. 一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
一定条件下,通过下列反应可实现燃煤烟气中硫的回收: