题目内容
(12分)两组同学对铁及其化合物的性质进行探究。
(1)一组同学用图1所示装置对铁与浓硫酸的反应进行实验。已知:
2Fe + 6H2SO4(浓) Fe2(SO4)3 + 3SO2↑+
6H2O。请你参与探究并回答相关问题。
Fe2(SO4)3 + 3SO2↑+
6H2O。请你参与探究并回答相关问题。
①检查装置气密性后,将过量的铁屑和一定量的浓硫酸放入烧瓶,塞紧橡皮塞,开始计时t1时开始加热,在铁屑表面逐渐产生气泡,当有大量气泡产生时,控制反应温度基本不变。甲同学将收集到的气体体积与时间的关系粗略地表示为图2。
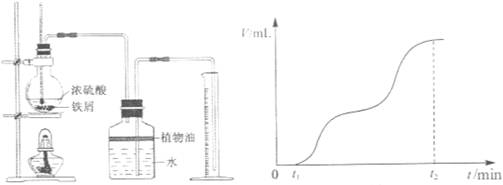
图1 图2
在0~t1时间段,铁屑表面没有气泡生成,说明铁在浓硫酸中发生了__________;t1~t2时间段,反应生成的气体是__________。
②t2时,取少量反应液,先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色。若再滴加过量新制氯水,却发现红色褪去。同学们对红色褪去的原因提出各自的假设。乙同学的假设是:溶液中的+3价铁被氧化为更高的价态。你的另一种假设是__________;为了验证你的假设,请设计一种简便的实验方案__________。
(2)另一组同学对铁和稀硝酸的反应进行探究。他们用a mol Fe和含有b mol HNO3的稀硝酸进行实验,若HNO3只被还原成NO,且反应结束后溶液中含有Fe3+和Fe2+,则a/b的取值范围是__________;若反应结束后的溶液中n(Fe3+):n(Fe2+)=2:1,则的值为__________。
.(1) ① 钝化,SO2
② 溶液中的SCN-被氧化,向褪色后的溶液中加FeCl3,若溶液不褪色则假设成立
(2) 1/4 < a/b <3/8 ,9/32
【解析】(1)①常温下铁在浓硫酸中发生钝化,所以得不到气体。随着温度的升高,fie被浓硫酸氧化生成SO2气体。
②氯水褪色,说明氯水被还原。因此除了铁离子还原之外,也可能是被溶液中的SCN-还原。
所以可以通过检验SCN-来鉴别,即向褪色后的溶液中加FeCl3,若溶液不褪色则假设成立。
(2)铁和硝酸的反应的方程式是Fe+4HNO3=Fe(NO3)3+NO↑+2H2O。如果铁过量,则方程式是3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O。反应结束后溶液中含有Fe3+和Fe2+,则a/b的取值范围是 1/4 < a/b <3/8 ;反应结束后的溶液中n(Fe3+):n(Fe2+)=2:1,则生成硝酸铁和硝酸亚铁分别是2a/3mol和a/3mol,所以被还原的硝酸是(b-2a-2a/3)mol。根据电子的得失守恒可知,2a/3×3+a/3×2=(b-2a-2a/3)×3,解得a︰b=9︰32。



 Fe2(SO4)3 + 3SO2↑+ 6H2O。
Fe2(SO4)3 + 3SO2↑+ 6H2O。

 Fe2(SO4)3
+ 3SO2↑+ 6H2O。
Fe2(SO4)3
+ 3SO2↑+ 6H2O。
 Fe2(SO4)3
+ 3SO2↑+ 6H2O。请你参与探究并回答相关问题。
Fe2(SO4)3
+ 3SO2↑+ 6H2O。请你参与探究并回答相关问题。
 的取值范围是 ;为证实上述混合液中含有Fe2+,可以采取这样的做法:先取样,再加入
试剂,观察到溶液发生明显的颜色变化时,可以说明Fe2+的存在。
的取值范围是 ;为证实上述混合液中含有Fe2+,可以采取这样的做法:先取样,再加入
试剂,观察到溶液发生明显的颜色变化时,可以说明Fe2+的存在。