题目内容
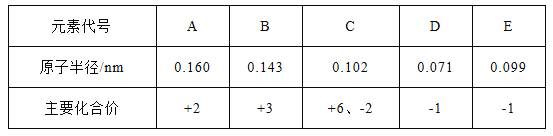
【题目】下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是( )
A. 简单离子半径大小关系为B3+>A2+
B. 气态氢化物的稳定性HD<H2C
C. 形成的简单离子的还原性E->D-
D. 最高价氧化物对应的水化物的酸性H2CO4>HEO4
【答案】C
【解析】由元素的化合价可知,D、E为-1价,则D为F元素,E为Cl元素;C主要化合价为-2、+6价,可知C为S元素;A为+2价,原子半径等于S元素,故A为Mg元素;B为+3价,原子半径小于Mg大于S,故B为Al元素。A、金属性Mg比Al强,则Mg与酸反应越剧烈,则相同条件下单质与稀盐酸反应速率为A>B,故A错误;B、非金属性F>Cl,非金属性越强,阴离子的还原性越弱,D、E形成的简单离子的还原性E->D-,故B正确;C、非金属性F>S,非金属性越强,氢化物越稳定,气态氢化物的稳定性HD>H2C,故C错误;D、非金属性Cl>S,非金属性越强,最高价氧化物对应的水化物的酸性越强,酸性H2CO4<HEO4,故D错误。

练习册系列答案
相关题目