题目内容
【题目】Ⅰ![]() 在某温度时按
在某温度时按![]() :
:![]() :3的比例将混合气体投入密闭容器中反应:
:3的比例将混合气体投入密闭容器中反应:![]() ;
;
![]() 在恒容条件下该反应达到化学平衡状态的依据是 ______
在恒容条件下该反应达到化学平衡状态的依据是 ______ ![]() 选填序号
选填序号![]() .
.
![]() :
:![]() :1
:1
![]() :
:![]() :2
:2
![]() :
:![]() :2
:2
![]() 容器内压强保持不变
容器内压强保持不变
![]() 反应达到平衡后,某时刻改变下列条件 ______ ,在达到新平衡的过程中正反应速率始终增大.
反应达到平衡后,某时刻改变下列条件 ______ ,在达到新平衡的过程中正反应速率始终增大.
![]() 升温
升温![]() 加压
加压![]() 增大
增大![]()
![]() 降低
降低![]()
![]() 某科研小组探究在其他条件不变的情况下,改变起始物氢气的物质的量对合成
某科研小组探究在其他条件不变的情况下,改变起始物氢气的物质的量对合成![]() 反应的影响.实验结果如图1所示:
反应的影响.实验结果如图1所示:![]() 图中
图中![]() 和
和![]() 表示温度,n表示起始时
表示温度,n表示起始时![]() 的物质的量
的物质的量![]()
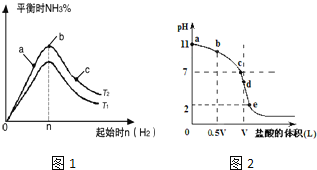
![]() 图象中
图象中![]() 和
和![]() 的关系是:
的关系是:![]() ______
______ ![]() 填“
填“![]() ”、“
”、“![]() ”、“
”、“![]() ”或“无法确定”
”或“无法确定”![]() .
.
![]() 比较在a、b、c三点所处的平衡状态中,反应物
比较在a、b、c三点所处的平衡状态中,反应物![]() 的转化率最大的是 ______
的转化率最大的是 ______ ![]() 填字母
填字母![]() .
.
![]() 若容器容积为1L,b点对应的
若容器容积为1L,b点对应的![]() ,测得平衡时
,测得平衡时![]() 的转化率为
的转化率为![]() ,则平衡时
,则平衡时![]() 的物质的量浓度为 ______
的物质的量浓度为 ______ ![]() .
.
Ⅱ![]() 常温时向浓度为
常温时向浓度为![]() 体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图2图象回答下列问题:
体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图2图象回答下列问题:
![]() 比较b、c、d三点时的溶液中,水电离的
比较b、c、d三点时的溶液中,水电离的![]() 由大到小的顺序为 ______ .
由大到小的顺序为 ______ .
![]() 滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有 ______ .
滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有 ______ .
![]() b.
b.![]()
![]() 该温度时氨水的电离平衡常数
该温度时氨水的电离平衡常数![]() ______ .
______ .
【答案】d a ![]() c
c ![]()
![]() cd
cd ![]()
【解析】
I.![]() 没有明确正逆速率,不能确定是否处于平衡状态;
没有明确正逆速率,不能确定是否处于平衡状态;
![]() 平衡时氮气、氨气的物质的量关系与氮气的转化率有关;
平衡时氮气、氨气的物质的量关系与氮气的转化率有关;
![]() 平衡时氢气、氨气的浓度关系与氢气转化率有关;
平衡时氢气、氨气的浓度关系与氢气转化率有关;
![]() 正反应为气体物质的量减小的反应,随反应进行,压强减小,容器内压强保持不变说明到达平衡;
正反应为气体物质的量减小的反应,随反应进行,压强减小,容器内压强保持不变说明到达平衡;
![]() 升温温度,瞬间正逆速率都增大,正反应为放热反应,逆反应速率增大较大,平衡向逆反应移动,逆反应速率减小、正反应速率增大至平衡;
升温温度,瞬间正逆速率都增大,正反应为放热反应,逆反应速率增大较大,平衡向逆反应移动,逆反应速率减小、正反应速率增大至平衡;
![]() 加压,瞬间正逆反应速率都增大,正反应为气体体积减小的反应,正反应速率增大较大,平衡向正反应移动,正反应速率减小、逆反应速率增大至平衡;
加压,瞬间正逆反应速率都增大,正反应为气体体积减小的反应,正反应速率增大较大,平衡向正反应移动,正反应速率减小、逆反应速率增大至平衡;
![]() 增大
增大![]() ,瞬间正反应增大、逆反应速率不变,平衡正向移动,正反应速率减小、逆反应速率增大到平衡状态;
,瞬间正反应增大、逆反应速率不变,平衡正向移动,正反应速率减小、逆反应速率增大到平衡状态;
![]() 降低
降低![]() ,瞬间正反应速率不变,逆反应速率减小,平衡正向移动,正反应速率减小、逆反应速率增大到平衡状态;
,瞬间正反应速率不变,逆反应速率减小,平衡正向移动,正反应速率减小、逆反应速率增大到平衡状态;
![]() 由图可知,
由图可知,![]() 相同时,温度
相同时,温度![]() 对应氨气含量高,反应为放热反应,降低温度有利于生成氨气;
对应氨气含量高,反应为放热反应,降低温度有利于生成氨气;
![]() 、b、c三点,
、b、c三点,![]() 越大,平衡正向移动的程度越大,
越大,平衡正向移动的程度越大,![]() 的转化率越大;
的转化率越大;
![]() ,起始体系中加入
,起始体系中加入![]() ,反应达到平衡时
,反应达到平衡时![]() 的转化率为
的转化率为![]() ,则转化的氢气为
,则转化的氢气为![]() ,则:
,则:
![]()
开始![]() :
:![]()
![]() 0
0
变化![]() :
:![]()
![]()
![]()
平衡![]() :
:![]()
![]()
![]()
进而计算氮气的平衡浓度;
Ⅱ![]() 在b点时,溶质为氨水和氯化铵,氨水的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用,在c点时,溶质为氨水和氯化铵,氨水的电离程度等于于氯化铵的水解程度,溶液为中性,对水的电离平衡无影响,在d点时,溶质为氯化铵,氯化铵发生水解,溶液为酸性,对水的电离平衡促进;
在b点时,溶质为氨水和氯化铵,氨水的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用,在c点时,溶质为氨水和氯化铵,氨水的电离程度等于于氯化铵的水解程度,溶液为中性,对水的电离平衡无影响,在d点时,溶质为氯化铵,氯化铵发生水解,溶液为酸性,对水的电离平衡促进;
![]() 滴定时,由b点到c点的过程中,碱性减弱,酸性增强,
滴定时,由b点到c点的过程中,碱性减弱,酸性增强,
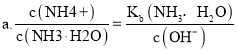 ;
;
![]() 由b点到c点的过程中,
由b点到c点的过程中,![]() 不断增大,
不断增大,![]() 不断减小;
不断减小;
![]() 为一水合氨的电离平衡常数,只与温度有关;
为一水合氨的电离平衡常数,只与温度有关;
![]() 是铵根离子水解平衡常数,只与温度有关;
是铵根离子水解平衡常数,只与温度有关;
![]() 未加HCl时,氨水浓度为
未加HCl时,氨水浓度为![]() ,溶液的
,溶液的![]() ,则溶液中
,则溶液中![]() ,水的电离程度较小,溶液中
,水的电离程度较小,溶液中![]() ,一水合氨电离程度较小,则
,一水合氨电离程度较小,则![]() ,代入氨水的电离平衡常数
,代入氨水的电离平衡常数![]() 计算.
计算.
解:![]() 没有明确正逆速率,不能确定是否处于平衡状态,若分别为正逆速率则处于平衡状态,故a错误;
没有明确正逆速率,不能确定是否处于平衡状态,若分别为正逆速率则处于平衡状态,故a错误;
![]() 平衡时氮气、氨气的物质的量关系与氮气的转化率有关,平衡时可能为1:2,也可能不是1:2,故b错误;
平衡时氮气、氨气的物质的量关系与氮气的转化率有关,平衡时可能为1:2,也可能不是1:2,故b错误;
![]() 平衡时氢气、氨气的浓度关系与氢气转化率有关,故c错误;
平衡时氢气、氨气的浓度关系与氢气转化率有关,故c错误;
![]() 正反应为气体物质的量减小的反应,随反应进行,压强减小,容器内压强保持不变说明到达平衡,故d正确,
正反应为气体物质的量减小的反应,随反应进行,压强减小,容器内压强保持不变说明到达平衡,故d正确,
故选:d;
![]() 升温温度,瞬间正逆速率都增大,正反应为放热反应,逆反应速率增大较大,平衡向逆反应移动,逆反应速率减小、正反应速率增大至平衡,在达到新平衡的过程中正反应速率始终增大,故a符合;
升温温度,瞬间正逆速率都增大,正反应为放热反应,逆反应速率增大较大,平衡向逆反应移动,逆反应速率减小、正反应速率增大至平衡,在达到新平衡的过程中正反应速率始终增大,故a符合;
![]() 加压,瞬间正逆反应速率都增大,正反应为气体体积减小的反应,正反应速率增大较大,平衡向正反应移动,正反应速率减小、逆反应速率增大至平衡,故b不符合;
加压,瞬间正逆反应速率都增大,正反应为气体体积减小的反应,正反应速率增大较大,平衡向正反应移动,正反应速率减小、逆反应速率增大至平衡,故b不符合;
![]() 增大
增大![]() ,瞬间正反应增大、逆反应速率不变,平衡正向移动,正反应速率减小、逆反应速率增大到平衡状态,故c不符合;
,瞬间正反应增大、逆反应速率不变,平衡正向移动,正反应速率减小、逆反应速率增大到平衡状态,故c不符合;
![]() 降低
降低![]() ,瞬间正反应速率不变,逆反应速率减小,平衡正向移动,正反应速率减小、逆反应速率增大到平衡状态,故d不符合,
,瞬间正反应速率不变,逆反应速率减小,平衡正向移动,正反应速率减小、逆反应速率增大到平衡状态,故d不符合,
故选:a;
![]() 由图可知,
由图可知,![]() 相同时,温度
相同时,温度![]() 对应氨气含量高,反应为放热反应,降低温度有利于生成氨气,则
对应氨气含量高,反应为放热反应,降低温度有利于生成氨气,则![]() ,故答案为:
,故答案为:![]() ;
;
![]() 、b、c三点,
、b、c三点,![]() 越大,平衡正向移动的程度越大,
越大,平衡正向移动的程度越大,![]() 的转化率越大,c点时氢气的物质的量最大,c点
的转化率越大,c点时氢气的物质的量最大,c点![]() 的转化率最高,故答案为:c;
的转化率最高,故答案为:c;
![]() ,起始体系中加入
,起始体系中加入![]() ,反应达到平衡时
,反应达到平衡时![]() 的转化率为
的转化率为![]() ,则转化的氢气为
,则转化的氢气为![]() ,则:
,则:
![]()
开始![]() :
:![]()
![]() 0
0
变化![]() :
:![]()
![]()
![]()
平衡![]() :
:![]()
![]()
![]()
故氮气的平衡浓度为![]() ,故答案为:
,故答案为:![]() ;
;
Ⅱ![]() 在b点时,溶质为氨水和氯化铵,氨水的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用,在c点时,溶质为氨水和氯化铵,氨水的电离程度等于于氯化铵的水解程度,溶液为中性,对水的电离平衡无影响,在d点时,溶质为氯化铵,氯化铵发生水解,溶液为酸性,对水的电离平衡促进,所以b、c、d三点时的溶液中,水电离的
在b点时,溶质为氨水和氯化铵,氨水的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用,在c点时,溶质为氨水和氯化铵,氨水的电离程度等于于氯化铵的水解程度,溶液为中性,对水的电离平衡无影响,在d点时,溶质为氯化铵,氯化铵发生水解,溶液为酸性,对水的电离平衡促进,所以b、c、d三点时的溶液中,水电离的![]() 大小顺序为:
大小顺序为:![]() ,
,
故答案为:![]() ;
;
![]() 滴定时,由b点到c点的过程中,碱性减弱,酸性增强,
滴定时,由b点到c点的过程中,碱性减弱,酸性增强,
 ,由b点到c点的过程中,
,由b点到c点的过程中,![]() 不断减小,故该值增大,故a不符合;
不断减小,故该值增大,故a不符合;
![]() 由b点到c点的过程中,
由b点到c点的过程中,![]() 不断增大,
不断增大,![]() 不断减小,
不断减小,![]() 的值逐渐减小,故b不符合;
的值逐渐减小,故b不符合;
![]() 为一水合氨的电离平衡常数,只与温度有关,滴定过程中不变,故c符合;
为一水合氨的电离平衡常数,只与温度有关,滴定过程中不变,故c符合;
![]() 是铵根离子水解平衡常数,只与温度有关,滴定过程中不变,故d符合;
是铵根离子水解平衡常数,只与温度有关,滴定过程中不变,故d符合;
故选:cd;
![]() 未加HCl时,氨水浓度为
未加HCl时,氨水浓度为![]() ,溶液的
,溶液的![]() ,则溶液中
,则溶液中![]() ,水的电离程度较小,溶液中
,水的电离程度较小,溶液中![]() ,一水合氨电离程度较小,则
,一水合氨电离程度较小,则![]() ,氨水的电离平衡常数
,氨水的电离平衡常数![]() ,
,
故答案为:![]() .
.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题。
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | C | N | O | F | Ne | |||
3 | Na | Al | P | S | Cl |
(1)单质的化学性质最不活沷的元素是__________;
(2)氧的原子结构示意图是__________;
(3)形成化合物种类最多的元素是__________;
(4)HF和H2O中,热稳定性较强的是__________;
(5)N和P中,原子半径较小的是__________;
(6)常温下,会在浓硫酸中发生钝化的金属是_________;
(7)元素最高价氧化物对应水化物中,碱性最强的是___(填化学式),酸性最强的是_____(填“H2SO4”或“ HClO4”);
【题目】在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
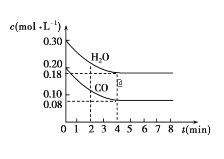
请解答下列各题:
(1)0~4min内的平均反应速率v(CO)=___mol/(L·min),v(H2)=___mol/(L·min),v(CO2)=___mol/(L·min)。
(2)请你在图中标出CO2和H2的浓度变化。___
(3)T℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表。
时间(min) | 0 | 2 | 3 | 4 | 5 | 6 |
CO | 0.200 | 0.138 | c1 | c1 | 0.116 | 0.096 |
H2O | 0.300 | 0.238 | c2 | c2 | 0.216 | 0.266 |
CO2 | 0 | 0.062 | c3 | c3 | 0.084 | 0.104 |
H2 | 0 | 0.062 | c4 | c4 |
①表中3min~4min之间,反应处于___状态;c1___0.08mol/L(填“大于”、“小于”或“等于”)。
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是___(单选),表中5min~6min之间数值发生变化,可能的原因是___(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
【题目】钛广泛应用于航天、军事、化工、医疗等领域。钛在高温下易和氧、氮、碳等元素化合,提炼纯钛条件苛刻。从高钛渣![]() 主要为
主要为![]() 提炼海绵钛流程如下:
提炼海绵钛流程如下:
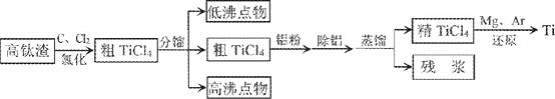
氯化后的粗![]() 中含有
中含有![]() 、
、![]() 、
、![]() 、
、![]() 等杂质,相关物质的沸点如下表:
等杂质,相关物质的沸点如下表:
化合物 |
|
|
|
|
|
沸点 | 136 | 310 |
| 180 | 138 |
回答下列问题:
![]() 高钛渣经过破碎、磁选、磨粉后送氯化车间,磨粉的目的是________。
高钛渣经过破碎、磁选、磨粉后送氯化车间,磨粉的目的是________。
![]() “分馏
“分馏![]() ,原因是________。加入铝粉使
,原因是________。加入铝粉使![]() 转化为
转化为![]() 便于除去,写出铝粉与
便于除去,写出铝粉与![]() 反应的化学方程式:________。
反应的化学方程式:________。
![]() “除铝”的方法是用水湿润的活性炭加入到粗
“除铝”的方法是用水湿润的活性炭加入到粗![]() ,使
,使![]() 转化为________而除去。
转化为________而除去。
![]() “还原”需要在Ar的气氛中进行,原因是________。副产物经电解生成________可循环使用。
“还原”需要在Ar的气氛中进行,原因是________。副产物经电解生成________可循环使用。
![]() 制备钛的一种新型方法是:将
制备钛的一种新型方法是:将![]() 粉末浇注成形,烧结后作阴极,以石墨为阳极,
粉末浇注成形,烧结后作阴极,以石墨为阳极,![]() 为熔盐进行电解
为熔盐进行电解![]() 熔盐不参与电极反应,起溶解和传导
熔盐不参与电极反应,起溶解和传导![]() 的作用
的作用![]() 。
。
![]() 阳极生成的气体除
阳极生成的气体除![]() 外,还有________
外,还有________![]() 填化学式
填化学式![]() 。
。
![]() 阴极的电极反应式为________。
阴极的电极反应式为________。