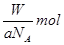题目内容
(14分) 0.012Kg 12C所含的碳原子数约为 ① 个;3.01×1023个氢分子的物质的量为 ② mol;标况下,2.24L CO的物质的量为 ③ mol,其中原子数目共有 ④ 个;1g CO与 ⑤ g N2所含分子数相同;同温同压下,同体积的N2和SO2原子总数之比为 ⑥ ,密度之比为 ⑦ 。
(14分,每空2分)①6.02×1023个;②0.5mol;③ 0.1mol;
④1.204×1023或0.2 NA;⑤ 1 ;⑥2:3 ; ⑦ 7:16;
④1.204×1023或0.2 NA;⑤ 1 ;⑥2:3 ; ⑦ 7:16;
0.012Kg 12C是1mol,含有6.02×1023个碳原子;3.01×1023个氢分子的物质的量为3.01×1023÷6.02×1023/mol=0.5mol;况下,2.24L CO的物质的量为2.24L÷22.4L/mol=0.1mol,根据化学式可知含有0.2mol原子,数目是0.2 NA;1g CO是1/28mol,所以相同分子数的氮气是1/28mol×28g/mol=1g;氮气含有2个原子,SO2含有3个原子,所以;同温同压下,同体积的N2和SO2原子总数之比为2︰3。气体的密度之比是相应的摩尔质量之比,所以氮气和SO2的密度之比是28︰64=7︰16。

练习册系列答案
相关题目