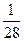题目内容
有100 mL混合气体,可能由NH3、HCl、CO2和NO组成,把混合气体通过浓H2SO4,气体体积减少30 mL,再经过Na2O2,气体又减少30 mL,最后经过水,剩余气体为20 mL(均在同温同压下测定,且不考虑水蒸气体积)。问:
(1)该混合气体由哪些气体混合而成?各占多少毫升?
(2)最后剩余20 mL是什么气体?简要说明理由。
(1)该混合气体由哪些气体混合而成?各占多少毫升?
(2)最后剩余20 mL是什么气体?简要说明理由。
(1)混合气体由NH3、CO2、NO组成,其中V(NH3)="30" mL,
V(CO2)="30" mL,V(NO)="40" mL。
(2)最后剩余的20 mL气体为NO。
V(CO2)="30" mL,V(NO)="40" mL。
(2)最后剩余的20 mL气体为NO。
混合气体通过浓H2SO4,体积减少30 mL,即V(NH3)="30" mL,由NH3的存在知不可能有HCl气体,则剩余气体为CO2和NO体积为100 mL-30 mL="70" mL
设CO2体积为x,则NO为(70 mL-x),
由反应方程式:2CO2+2Na2O2====2Na2CO3+O2可知生成的O2体积为 。
。
①若氧气过量
2NO + O2 ="=== " 2NO2
2 1 2
70 mL-x 70 mL-x
70 mL-x
所以有 -
- +70 mL="40" mL
+70 mL="40" mL
解之,不合理。
②若NO过量,依题意有
2NO+O2====2NO2
2 1 2
x x
x
(70 mL-x)-x+x="40" mL
所以x="30" mL
即V(CO2)="30" mL
V(NO)="70" mL-30 mL="40" mL
由上可知NO过量了10 mL,生成了30 mL NO2,经过水后,最后剩余的20 mL气体为NO,因为由
3NO2+H2O====2HNO3+NO
30 10
生成了10 mL NO,加上过量的10 mL,共20 mL NO。
设CO2体积为x,则NO为(70 mL-x),
由反应方程式:2CO2+2Na2O2====2Na2CO3+O2可知生成的O2体积为
 。
。①若氧气过量
2NO + O2 ="=== " 2NO2
2 1 2
70 mL-x
 70 mL-x
70 mL-x所以有
 -
- +70 mL="40" mL
+70 mL="40" mL解之,不合理。
②若NO过量,依题意有
2NO+O2====2NO2
2 1 2
x
 x
x(70 mL-x)-x+x="40" mL
所以x="30" mL
即V(CO2)="30" mL
V(NO)="70" mL-30 mL="40" mL
由上可知NO过量了10 mL,生成了30 mL NO2,经过水后,最后剩余的20 mL气体为NO,因为由
3NO2+H2O====2HNO3+NO
30 10
生成了10 mL NO,加上过量的10 mL,共20 mL NO。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
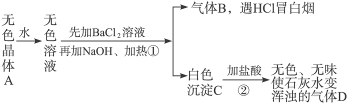
相关题目
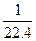
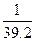 <c<
<c<