题目内容
(1)按反应中的理论值,SO2和O2的体积比为2:1,但实际生产中这个比值是多少?为什么?
(2) 通过计算说明为什么尾气以5 m3/h的速率与20 L/h速率的氨气混合?
(3) 若该厂每天排放10000 m3尾气,求该厂每月(按30天计算)可得到(NH4)2SO4的质量为多少?
(1)根据2SO2+O2≒ 2 SO3,SO2和 O2按2:1(体积比)的理论值反应,但实际上v(SO2):v(O2)=0.2%:10%=1:50。根据化学平衡移动原理,增大廉价的氧气的浓度,可使反应:2SO2(g)+O2(g) ≒ 2 SO3(g)向生成三氧化硫方向移动,这样可以增大较贵重的二氧化硫的转化率。
(2) 2NH3 ~ SO2
2 1
V(NH3) 5×103×0.2%L/h v(NH3)=20L/h
(3)根据2SO2+O2≒ 2 SO3,以及SO3+H2O+2NH3=(NH4)2SO4
得关系式: SO2 ~ 2NH3~(NH4)2SO4
22.4L 132g
107L×0.2%×30 m[(NH4)2SO4]
m[(NH4)2SO4]=3.54×106g=3.54t
(2) 2NH3 ~ SO2
2 1
V(NH3) 5×103×0.2%L/h v(NH3)=20L/h
(3)根据2SO2+O2≒ 2 SO3,以及SO3+H2O+2NH3=(NH4)2SO4
得关系式: SO2 ~ 2NH3~(NH4)2SO4
22.4L 132g
107L×0.2%×30 m[(NH4)2SO4]
m[(NH4)2SO4]=3.54×106g=3.54t
(1)根据2SO2+O2≒ 2 SO3,SO2和 O2按2:1(体积比)的理论值反应,但实际上v(SO2):v(O2)=0.2%:10%=1:50。根据化学平衡移动原理,增大廉价的氧气的浓度,可使反应:2SO2(g)+O2(g) ≒ 2 SO3(g)向生成三氧化硫方向移动,这样可以增大较贵重的二氧化硫的转化率。
(3) 2NH3 ~ SO2
2 1
V(NH3) 5×103×0.2%L/h v(NH3)=20L/h
(3)根据2SO2+O2≒ 2 SO3,以及SO3+H2O+2NH3=(NH4)2SO4
得关系式: SO2 ~ 2NH3~(NH4)2SO4
22.4L 132g
107L×0.2%×30 m[(NH4)2SO4]
m[(NH4)2SO4]=3.54×106g=3.54t
(3) 2NH3 ~ SO2
2 1
V(NH3) 5×103×0.2%L/h v(NH3)=20L/h
(3)根据2SO2+O2≒ 2 SO3,以及SO3+H2O+2NH3=(NH4)2SO4
得关系式: SO2 ~ 2NH3~(NH4)2SO4
22.4L 132g
107L×0.2%×30 m[(NH4)2SO4]
m[(NH4)2SO4]=3.54×106g=3.54t

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2NaNO2+H2O
2NaNO2+H2O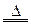 2CuO CuO+H2SO4
2CuO CuO+H2SO4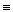 CH+H2O
CH+H2O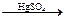 CH3CHO
CH3CHO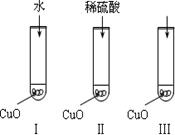
 (1)某同学提出的假设是 ;
(1)某同学提出的假设是 ;