题目内容
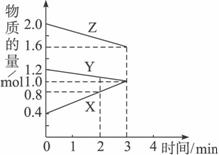
某温度时,在3 L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
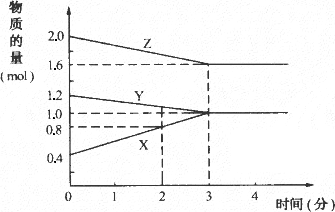
(1)该反应的化学方程式:________;
(2)反应开始至2 min末,X的反应速率为________;
(3)该反应是由________开始反应的.(①正反应 ②逆反应 ③正逆反应同时.)
解析:
|
思路与技巧:首先要看清图中横坐标、纵坐标及曲线的变化趋势从中找到X、Y、Z转化的物质的量及物质的量之比,便可写出化学方程式.然后据反应速率的概念,可求出X的反应速率,再据曲线是否通过原点,可判断可逆反应进行的方向. (1)在时间为3 min时,X、Y、Z的物质的量分别为1.0、1.0、1.6,在时间为“0”时物质的量分别为0.4、1.2、2.0,故物质的量变化为: X由0.4 mol Y由1.2 mol Z由2.0 mol 转化的物质的量之比X∶Y∶Z=3∶1∶2 据转化的物质的量之比=化学方程式各物质的系数比,得到化学方程式为:2Z+Y (2)2 min末,X的物质的量为0.8 mol,增加的物质的量为0.8-0.4=0.4(mol),容积为3 L的容器,则物质的量浓度为0.4/3(mol/L),再除以时间,得X的反应速率为0.4/3×2=0.067(mol/L·min) (3)图中X、Y、Z三条曲线均未通过原点可断定该反应是由正、逆反应同时开始反应的,则③为答案. |
提示:
|
本题为考查识图能力,化学反应速率的概念及简单计算;根据转化的物质的量之比与化学方程式中各物质的系数比相等书写化学方程式等内容的图像题.遇到图像题,一定要看清横、纵坐标,注意单位.本题给出的纵坐标是物质的量,不是物质的量浓度,如果忘记除以3 L,就会得0.3 mol/L·min.本题速率的单位是mol/L·min,而不是mol/L·s. |

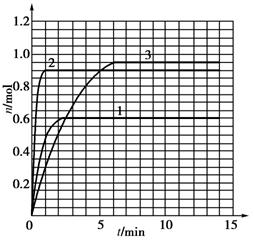
(10分)某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
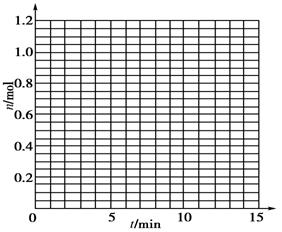
1根据下表中数据,在下图中画出X、Y、Z的物质的量n随时间t变化的曲线:
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
1 |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |
2体系中发生反应的化学方程式是_____________;
3列式计算该反应在0~3 min时间内产物Z的平均反应速率:______________________;
4该反应达到平衡时反应物X的转化率α等于________;
5如果该反应是放热反应。在该反应达到上述平衡状态时改变实验条件温度、压强、催化剂得到Z的物质的量(mol)随时间t(min)变化的曲线1、2、3如上右图所示则曲线1、2、3所对应的实验条件改变分别是:1______________,2______________,3______________。