题目内容
钛是20世纪50年代发展起来的一种重要的结构金属,钛合金因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。
(1)与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有?????? (填元素符号)。
(2)[Ti(OH)2(H2O)4]2+中的化学键有???????? 。
A.σ键?? ? B.π键??? ?? C.离子键??? ?? D.配位键
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如下图所示。
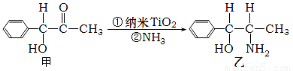
化合物甲的分子中采取sp2杂化方式的碳原子个数为???????? ,化合物乙中采取sp3杂化的原子的第一电离能由小到大的顺序为???????? 。
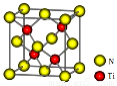
(4)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为???? ,该晶体中Ti原子周围与它距离最近且相等的N原子的个数______。
(1)Ni、Ge、Se(2)A? D(3)7;C<O<N(4)TiN;4
【解析】
试题分析:(1)Ti是22号元素,核外电子排布式是1s22s22p63s23p63d24s2.位于第四周期,第四副族.其未成对电子数为2个。在第四周期的所有元素的基态原子中,未成对电子数与钛相同的元素有Ni核外电子排布式是1s22s22p63s23p63d84s2.,Ge核外电子排布式是:1s22s22p63s23p64s24p2、Se 核外电子排布式是1s22s22p63s23p64s24p4. (2)在[Ti(OH)2(H2O)4]2+中的化学键有σ键和配位键。选项为AD。(3)在化合物甲 中的苯环上的6个C原子和羰基的C原子,一共7个。在化合物乙
中的苯环上的6个C原子和羰基的C原子,一共7个。在化合物乙 中采取sp3杂化的原子有除了苯环的以外的C原子、N原子、O原子。其中N原子的核外电子排布式为1s22s22p3,处于半充满的稳定状态,失去电子比较难。一般情况下,元素的原子序数越大,原子半径越小,原子的第一电离能就越大。所以这三种元素原子的第一电离能由小到大的顺序为C<O<N。(4)由氮化钛晶体的晶胞图可知:在每个晶胞中含有N:8×1/8+6×1/2=4;Ti:4.二者的个数比为1:1,所以该晶体的化学式为TiN。在该晶体中Ti原子周围与它距离最近且相等的N原子的个数为4,它们形成的是正四面体结构,Ti在正四面体的几何中心。
中采取sp3杂化的原子有除了苯环的以外的C原子、N原子、O原子。其中N原子的核外电子排布式为1s22s22p3,处于半充满的稳定状态,失去电子比较难。一般情况下,元素的原子序数越大,原子半径越小,原子的第一电离能就越大。所以这三种元素原子的第一电离能由小到大的顺序为C<O<N。(4)由氮化钛晶体的晶胞图可知:在每个晶胞中含有N:8×1/8+6×1/2=4;Ti:4.二者的个数比为1:1,所以该晶体的化学式为TiN。在该晶体中Ti原子周围与它距离最近且相等的N原子的个数为4,它们形成的是正四面体结构,Ti在正四面体的几何中心。
考点:考查原子结构、化学键的种类、晶体的化学式的推导、第一电离能的大小比较的知识。
