题目内容
甲、乙两烧杯中分别盛有100mL 3.0mol·L—1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成气体体积比:甲∶乙=1∶2,则加入铝粉的质量为
| A.5.4g | B.3.6g | C.2.7g | D.1.8g |
A
解析试题分析:由题意,加入等质量的铝粉得到氢气不等,说明有一烧杯中铝过量,由盐酸和NaOH溶液物质的量相等,结合铝消耗的酸多,消耗碱的量少,可知盐酸先消耗完,盐酸中铝过量,NaOH溶液中铝反应完全;由盐酸的物质的量为0.3mol,可制得氢气0.15mol,则铝与NaOH溶液制的氢气为0.3mol ,需要铝为0.2mol ,其质量为5.4g。选A。
考点:本题考查铝的两性,熟记铝与酸和碱反应的物质的量比例关系。

下列关于钠及其化合物的叙述,正确的是( )
| A.发酵粉中含有碳酸氢钠,能使焙制出的糕点疏松多孔 |
| B.氧化钠可用于呼吸面具中作为氧气的来源 |
| C.碳酸钠的水溶液呈中性 |
| D.硫酸钠灼烧时火焰呈紫色 |
有关苏打和小苏打的叙述正确的是
| A.苏打和小苏打都既能与酸反应又能与氢氧化钠反应 |
| B.与足量稀硫酸反应,生成等量的二氧化碳消耗的苏打的物质的量比小苏打多 |
| C.向小苏打溶液中滴入氢氧化钡溶液无沉淀,而苏打溶液中滴入氢氧化钡溶液出现沉淀 |
| D.等质量的苏打、小苏打分别与足量稀硫酸反应,小苏打产生的二氧化碳多 |
15g铁粉和氧化铁的混合物,放入150mL稀H2SO4中,发现固体完全溶解,并放出1.68L H2(标准状况),加入KSCN溶液后,无颜色变化。为了使Fe2+完全转化为Fe(OH)2沉淀,共耗用200mL 3 mol/L NaOH溶液,则原硫酸溶液的物质的量浓度为
| A.4 mol·L—1 | B.3 mol·L—1 | C.2 mol·L—1 | D.1 mol·L—1 |
Fe2O3和Al2O3都
| A.是两性氧化物 | B.可与氢氧化钠溶液反应 |
| C.可与盐酸反应 | D.可溶于水 |
将一小块金属钠投入下列物质的水溶液中,既能生成气体,又能生成白沉淀的是
| A.NH4Cl | B.BaCl2 | C.FeCl3 | D.MgSO4 |
将5.6g铁溶于足量稀盐酸中,再加入足量的氢氧化钠溶液,充分反应,过滤;在空气中加热所得滤渣,灼烧到质量不再变化,此时固体的质量为
| A.7.2g | B.8.0g | C.9.0g | D.10.7g |
将100mL 0.6 mol/L氯化铝溶液跟1mol/L氢氧化钠溶液混合后,得到3.9g Al(OH)3 沉淀,此时消耗氢氧化钠溶液的体积是
| A.130mL | B.180mL | C.190mL | D.240mL |
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )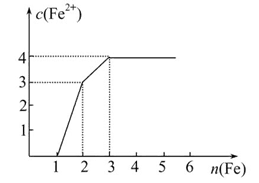
| A.1∶1∶1 | B.1∶3∶1 | C.3∶3∶8 | D.1∶1∶4 |