题目内容
在一定体积pH=12 的 Ba(OH)2溶液中,逐滴滴加一定物质的量浓度的 NaHSO4溶液,当溶液中的Ba2+ 恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与 NaHSO4溶液的体积比是
- A.1:9
- B.1:1
- C.1:2
- D.1:4
D
试题分析:pH=12 的 Ba(OH)2溶液,C(OH-)=0.01mol/L,C(Ba(OH)2)=0.005mol/L.逐滴滴加NaHSO4溶液,当溶液中的Ba2+ 恰好完全沉淀时,发生反应的离子方程式为: Ba2++OH-+H++SO42-=BaSO4↓+H2O.此时消耗的氢氧根离子的物质的量与钡离子相等。剩余的氢氧根离子的物质的量恰好为原来的一半。这时溶液pH=11,即C(OH-)=0.001mol/L,假设Ba(OH)2溶液的体积为V碱,NaHSO4溶液的体积为V酸。(0.005×V碱)÷(V酸+V碱)=0.001,解得V碱:V酸=1:4.选项为:D
考点:考查碱和酸式盐溶液混合时,混合液的PH的计算的知识。
试题分析:pH=12 的 Ba(OH)2溶液,C(OH-)=0.01mol/L,C(Ba(OH)2)=0.005mol/L.逐滴滴加NaHSO4溶液,当溶液中的Ba2+ 恰好完全沉淀时,发生反应的离子方程式为: Ba2++OH-+H++SO42-=BaSO4↓+H2O.此时消耗的氢氧根离子的物质的量与钡离子相等。剩余的氢氧根离子的物质的量恰好为原来的一半。这时溶液pH=11,即C(OH-)=0.001mol/L,假设Ba(OH)2溶液的体积为V碱,NaHSO4溶液的体积为V酸。(0.005×V碱)÷(V酸+V碱)=0.001,解得V碱:V酸=1:4.选项为:D
考点:考查碱和酸式盐溶液混合时,混合液的PH的计算的知识。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 溶液中,逐滴加入一定物质的量浓度的
溶液中,逐滴加入一定物质的量浓度的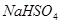 溶液,当溶液中的
溶液,当溶液中的 恰好完全沉淀时,溶液
恰好完全沉淀时,溶液 。若反应后溶液的体积等于
。若反应后溶液的体积等于