题目内容
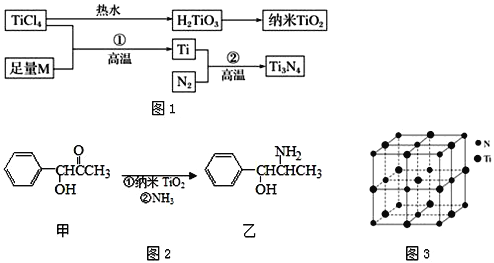
【题目】[化学——选修3:物质结构与性质]金属钛(Ti)被誉为21世纪金属,具有良好的生物相容性,它兼具铁的高强度和铝的低密度,其单质和化合物具有广泛的应用价值.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2(如图1).
图中的M是短周期金属元素,M的部分电离能如下表:
I1 | I2 | I3 | I4 | I5 | |
电离能/kJmol﹣1 | 738 | 1451 | 7733 | 10540 | 13630 |
请回答下列问题:
(1)Ti的基态原子外围电子排布式为_____________.
(2)M是_____(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为_____。
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示.化合物甲的分子中采取sp2方式杂化的碳原子有__ 个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为________________。
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为____________________gcm﹣3(NA为阿伏加德罗常数的值,只列计算式)。该晶体中与N原子距离相等且最近的N原子有__________。
(5)科学家通过X﹣射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据如下:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJmol﹣1 | 786 | 715 | 3401 |
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为_____________________.
【答案】3d24s2 Mg 12 7 O>N>C ![]() 12 TiN>CaO>KCl
12 TiN>CaO>KCl
【解析】
试题(1)Ti为22号元素,根据核外电子排布规律可知原子核外电子排布为1s22s22p63s23p63d24s2,则Ti的基态原子外围电子排布式为3d24s2。
(2)M是短周期金属元素,M的第三电离能剧增,处于ⅡA族,能与TiCl4反应置换出Ti,则M为Mg,Mg晶体属于六方最密堆积,配位数为12。
(3)化合物甲的分子中采取sp2杂化的碳原子为:苯环上的六个、羰基中的一个,共7个;采取sp3杂化的原子价层电子对数是4,乙中采取sp3杂化的原子有C、N、O,同一周期元素中,元素电负性随着原子序数依次增加电负性逐渐增大,所以它们的电负性关系为:O>N>C。
(4)根据均摊法,可知该晶胞中N原子个数为:6×1/2+8×1/8=4,该晶胞中Ti原子个数为:1+12×1/4=4,所以晶胞的质量m=![]() g,而晶胞的体积V=(2a×10-10)3cm3,所以晶体的密度ρ=
g,而晶胞的体积V=(2a×10-10)3cm3,所以晶体的密度ρ=![]() ;以晶胞顶点N原子研究,与之距离相等且最近的N原子处于面心位置,每个顶点为8个晶胞共用,每个面为2个晶胞共用,故与之距离相等且最近的N原子为
;以晶胞顶点N原子研究,与之距离相等且最近的N原子处于面心位置,每个顶点为8个晶胞共用,每个面为2个晶胞共用,故与之距离相等且最近的N原子为![]() =12;
=12;
(5)离子晶体的离子半径越小,带电荷数越多,晶格能越大,则晶体的熔沸点越高,则有TiN>CaO,由表中数据可知CaO>KCl,则TiN>CaO>KCl。

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案【题目】某实验小组用软锰矿制备高锰酸钾,主要实验步骤如下:
步骤一:将软锰矿(主要成分为MnO2)、KClO3和KOH固体按一定比例混合后强热可制得绿色K2MnO4;
步骤二:将反应后固体充分溶解、过滤,向滤液中通入过量CO2气体使溶液显酸性,K2MnO4在酸性条件下反应得到KMnO4、MnO2和K2CO3,最后分离得到高锰酸钾晶体。
请回答下列问题:
(1)请写出步骤一的化学方程式____________________________,此反应不能用瓷坩埚,原因是(用化学方程式表示)_________________________________;
(2)否用浓盐酸代替步骤二中的CO2 ,请简要分析原因__________________________;
(3)部分化合物的溶解度随温度的变化如下表所示,从步骤二反应后的混合溶液中分离得到高锰酸钾晶体的方法是蒸发浓缩、_____________,过滤、洗涤、烘干。为进一步增加得到的产品(高锰酸钾晶体)的纯度,常采用的实验方法是____________;
一些化合物的溶解度S/g(100g H2O)-1
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 |
K2CO3 | 51.3 | 52.0 | 52.5 | 53.2 | 53.9 | 54.8 |
KMnO4 | 2.83 | 4.4 | 9.0 | 12.7 | 16.9 | 22.2 |
(4)按以上方法制备高锰酸钾,每3 mol K2MnO4彻底反应理论上生成_________mol KMnO4;为增大锰酸钾的原子利用率,更好的制备方法是电解法。以K2MnO4溶液为电解液,采用惰性电极电解,当阴极在标准状况下产生5.6 L H2时,产生KMnO4的物质的量是________mol。