题目内容
8.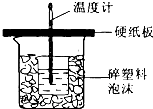 实验题:中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
实验题:中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒;装置的不足之处是小烧杯口和大烧杯口没有平齐;不加以改正,所求的值将偏小 (填偏大,偏小,无影响).
(2)实验中改用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”);所求中和热的数值会相等(填“相等”或“不相等”).
分析 (1)根据量热计的构造来判断该装置的缺少仪器;根据中和热的测定原理分析;小烧杯口和大烧杯口没有平齐,会使一部分热量散失;
(2)根据反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答.
解答 解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,内外烧杯为一样高,否则,热量散失大;小烧杯口和大烧杯口没有平齐,会使一部分热量散失,所求中和热的数值偏小;
故答案为:环形玻璃搅拌棒;小烧杯口和大烧杯口没有平齐;偏小;
(2)反应放出的热量和所用酸以及碱的量的多少有关,改用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;
故答案为:不相等;相等.
点评 本题考查学生中和热测定,保温工作是实验成功的关键,掌握实验原理即可解答,难度不大.

练习册系列答案
相关题目
18.甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL溶液为0.1mol•L-1的AlCl3溶液,两烧杯中都有沉淀生成.下列判断正确的是( )
| A. | 甲中沉淀一定比乙中的多 | B. | 甲中和乙中的沉淀一定一样多 | ||
| C. | 甲中沉淀一定比乙中的少 | D. | 甲中沉淀可能比乙中的多 |
19.下列化合物能发生消去反应,又能发生水解反应,还能发生催化氧化反应的是( )
| A. | CHCl3 | B. | CH3CH2Br | C. | CH3CH2OH | D. | CH2BrCH2CH2OH |
16.钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O=2Fe(OH)2; ②4Fe(OH)2+O2+2H2O=4Fe(OH)3; ③2Fe(OH)3=Fe2O3+3H2O.
下列说法正确的是( )
①2Fe+O2+2H2O=2Fe(OH)2; ②4Fe(OH)2+O2+2H2O=4Fe(OH)3; ③2Fe(OH)3=Fe2O3+3H2O.
下列说法正确的是( )
| A. | 反应①中氧化剂是氧气和水 | |
| B. | 钢铁在潮湿的空气中不能发生电化学腐蚀 | |
| C. | 反应①、②中电子转移数目相等 | |
| D. | 与铜质水龙头连接处的钢质水管不易发生腐蚀 |
3.下列变化中,需加入氧化剂才能实现的是( )
①MnO4-→Mn2+ ②S2-→S ③HCO3-→CO2 ④Cl2→Cl- ⑤NH4+→NH3 ⑥H2S→SO2.
①MnO4-→Mn2+ ②S2-→S ③HCO3-→CO2 ④Cl2→Cl- ⑤NH4+→NH3 ⑥H2S→SO2.
| A. | ①②④⑥ | B. | ②④⑥ | C. | ②⑥ | D. | ①④⑤ |
13.把下列四组物质分别溶于水,得到的四组水溶液中,含有的离子种类完全相同的是( )
①NH4Cl KNO3 Na2SO4
②K2SO4 NaNO3 NH4Cl
③NH4NO3 K2CO3 (NH4)2SO4 NaCl
④NaCl (NH4)2SO4 K2SO4 NaNO3.
①NH4Cl KNO3 Na2SO4
②K2SO4 NaNO3 NH4Cl
③NH4NO3 K2CO3 (NH4)2SO4 NaCl
④NaCl (NH4)2SO4 K2SO4 NaNO3.
| A. | ②③ | B. | ①② | C. | ③④ | D. | ①③ |
20.已知热化学方程式:C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol.2.5molC在氧气中完全燃烧生成二氧化碳,放出的热量为( )
| A. | 393.5kJ | B. | 983.75KJ | C. | 1075.5kJ | D. | 1185.5KJ |
