题目内容
设NA代表阿伏加德罗常数的数值,下列说法正确的是
A.标准状况下,1molCO2、CO的混合气中含有的氧原子数为1.5NA
B.标准状况下,11.2LCCl4所含的分子数为0.5NA
C.25℃,1.01×105Pa,66gCO2中所含原子数为4.5NA
D.1mol•L﹣1CuCl2溶液中含有的氯离子数为2NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。(忽略氧气对反应的影响)

实验记录如下:
实验序号 | 实验操作 | 实验现象 |
I | 向A装置中通入一段时间的SO2气体。 | A中黄色溶液迅速变成深红棕色,最终变为浅绿色。 |
II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液。 | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀。 |
III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a | A中浅绿色溶液最终变为黄色。 |
IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中通入空气。 | 溶液变为红色;液面上方有少量红棕色气体生成。 |
请回答下列问题:
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学方程式和简单文字叙述): 。
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为: Fe3+ + 6SO2  Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因 。
Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因 。
(3)实验II中发生反应的离子方程式是 。
(4)实验III中,浅绿色溶液变为黄色的原因是(用离子方程式表示) 。
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是 。
(6)综合上述实验得出的结论是:在酸性条件下,NO3-、SO42-、Fe3+三种微粒的氧化性由强到弱的顺序是: 。


 2CO(g)△H>0。该反应的达到平衡后,下列条件
2CO(g)△H>0。该反应的达到平衡后,下列条件 减小压强
减小压强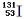
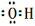
 m﹣3),得到的盐酸的密度为bg•mL﹣1,质量分数为w,物质的量浓度为cmol•
m﹣3),得到的盐酸的密度为bg•mL﹣1,质量分数为w,物质的量浓度为cmol• L﹣1则下列关系式中不正确的是
L﹣1则下列关系式中不正确的是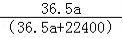
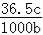
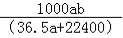
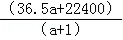
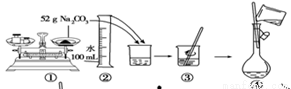
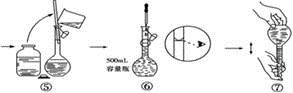
 2NH3(g)ΔH=-92.4kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g)ΔH=-92.4kJ·mol-1。一种工业合成氨的简式流程图如下: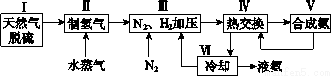


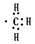 含有的电子数为9NA
含有的电子数为9NA