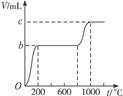
题目内容
某种碱金属的过氧化物11 g与二氧化碳气体完全反应后,固体质量增加了2.8 g,试判断此碱金属的相对原子质量是多少,是什么金属。
设碱金属原子为R,其相对原子质量为x。
2R2O2+2CO2====2R2CO3+O2 Δm
2(2x+32) 2(2x+60) 2(2x+60)-2(2x+32)=56
11 g 2.8 g
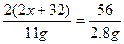 x=39
x=39
即此碱金属原子相对原子质量为39,查元素周期表知是钾。
2R2O2+2CO2====2R2CO3+O2 Δm
2(2x+32) 2(2x+60) 2(2x+60)-2(2x+32)=56
11 g 2.8 g
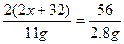 x=39
x=39即此碱金属原子相对原子质量为39,查元素周期表知是钾。
要判断碱金属的相对原子质量,首先要写出化学方程式,然后以题给条件用差量法列比例式进行计算。

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目