题目内容
从分类的角度研究右图所示实验,下列有关分析不正确是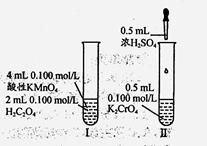
| A.Cr和Mn均为副族d区元素 |
| B.H2C2O4和H2SO4均为电解质 |
| C.反应II为非氧化还原反应 |
| D.I、II中随反应进行反应速率均逐渐减小 |
D
解析试题分析:A.Cr和Mn的外围电子排布分别为3d54s1、3d54s2,均为副族d区元素,正确;B.H2C2O4和H2SO4均为酸,都属于电解质,正确;C.发生反应为2CrO42+2H+=Cr2O72-+H2O,反应中各元素化合价未发生变化,属于非氧化还原反应,正确;D.反应Ⅰ生成Mn2+,Mn2+对反应具有催化作用,反应速率向增大,而后一段时间降低,反应Ⅱ为2CrO42+2H+=Cr2O72-+H2O,随反应进行离子浓度降低,反应速率较慢,错误.
考点:元素周期表的结构及其应用;氧化还原反应;化学反应速率的影响因素;电解质与非电解质

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
关于氯化镁溶液和氢氧化铁胶体的说法中正确的是( )
| A.溶液是电中性的,胶体是带电的 |
| B.两者的分散质微粒均能透过半透膜和滤纸 |
| C.溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
| D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
下列说法中不正确的是
| A.分散质微粒直径介于1nm~100 nm之间的分散系称为胶体 |
| B.在水溶液或熔融状态下能够导电的化合物中一定存在离子键 |
| C.液态氯化氧、熔融氧化铝、固体硫酸钡都是电解质 |
| D.非金属氧化物不一定是酸性氧化物,有些金属氧化物也能与强碱反应 |
下列实例中与胶体性质有关的是
| A.铁在空气中生锈 | B.用食醋除去水垢 |
| C.用石膏使豆浆变成豆腐 | D.用含Al(OH)3的药物治疗胃酸过多 |
判断下列有关化学基本概念的依据正确的是
| A.氧化还原反应:元素化合价是否变化 | B.共价化合物:是否含有共价键 |
| C.强弱电解质:溶液的导电能力大小 | D.氧化物:含氧化合物 |
下列叙述正确的是( )
| A.胶体区别于其他分散系的根本原因是胶体有丁达尔效应 |
| B.分散系中分散质粒子直径由小到大的正确顺序是:溶液<胶体<浊液 |
| C.向氢氧化钠溶液中边滴加饱和FeCl3溶液边振荡制备Fe(OH)3胶体 |
| D.胶体的分散质可以通过过滤从分散剂中分离出来 |
下列关于胶体的说法不正确的是
| A.可用渗析法提纯胶体 |
| B.胶体、溶液和浊液这三种分散系的根本区别是分散质粒子直径的大小 |
| C.胶体微粒不能透过滤纸 |
| D.往25 mL沸水中逐滴加入2 mL FeCl3饱和溶液,可以制得Fe(OH)3胶体 |
分类法是一种行之有效、简单易行的科学方法。某同学用如表所示的形式对所学知识进行分类,甲与乙、丙、丁是包含关系。其中正确的是
| 选项 | 甲 | 乙、丙、丁 |
| A | 弱电解质 | 一水合氨、水、硫酸钡 |
| B | 腐蚀品 | 浓硫酸、烧碱、硝酸 |
| C | 碱性氧化物 | 过氧化钠、氧化镁、氧化铁 |
| D | 合成高分子材料 | 光导纤维、涤纶、玻璃 |
 和
和