题目内容
(2013?济南一模)目前,新能源不断被利用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向.
(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中兴和酸性条件下不稳定.反应原理为:
Ⅰ.在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
Ⅱ.Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
主要的生产流程如下:
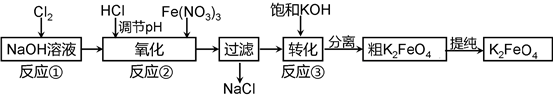
(2)①写出反应①的离子方程式
②流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4)
(3)已知K2FeO4在水溶液中可以发生:4FeO42-+10H2O?4Fe(OH)3↓+8OH-+3O2↑,则K2FeO4可以在水处理中的作用是
(4)FeO42-在水溶液中的存在形态图如下图所示.
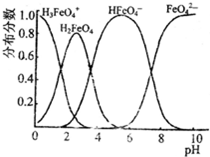
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数的变化情况是
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,
(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是
Zn
Zn
.(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中兴和酸性条件下不稳定.反应原理为:
Ⅰ.在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
Ⅱ.Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
主要的生产流程如下:

(2)①写出反应①的离子方程式
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
②流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4)
<
<
Ksp(Na2FeO4)(填“>”或“<”或“=”).(3)已知K2FeO4在水溶液中可以发生:4FeO42-+10H2O?4Fe(OH)3↓+8OH-+3O2↑,则K2FeO4可以在水处理中的作用是
杀菌消毒、净水
杀菌消毒、净水
.(4)FeO42-在水溶液中的存在形态图如下图所示.

①若向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数的变化情况是
先不大后变小
先不大后变小
.②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,
HFeO4-
HFeO4-
转化为FeO42-
FeO42-
(填化学式).分析:(1)原电池中易失电子的金属作负极;
(2)①氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
②相同温度下,溶度积大的物质向溶度积小的物质转化;
③高铁酸钠具有强氧化性,氢氧化铁胶体具有吸附性;
(4)①根据图象综横坐标的含义分析;
②根据含铁微粒浓度的变化分析.
(2)①氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
②相同温度下,溶度积大的物质向溶度积小的物质转化;
③高铁酸钠具有强氧化性,氢氧化铁胶体具有吸附性;
(4)①根据图象综横坐标的含义分析;
②根据含铁微粒浓度的变化分析.
解答:解:(1)该原电池中,锌易失电子发生氧化反应而作负极,故答案为:Zn;
(2)①氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
②相同温度下,溶度积大的物质向溶度积小的物质转化,所以Ksp(K2FeO4)<Ksp(Na2FeO4),故答案为:<;
(3)高铁酸钠具有强氧化性,所以能杀菌消毒,氢氧化铁胶体具有吸附性,所以能净水,故答案为:杀菌消毒、净水;
(4)①根据图象知,随着溶液酸性的增强,HFeO4-的分布分数先增大后减小,故答案为:先变大,后变小;
②根据图象知,随着溶液酸性的之间增强,FeO42-的分布分数逐渐增大,HFeO4-的分布分数逐渐减小,所以HFeO4-转化为FeO42-,故答案为:HFeO4-转化为FeO42-.
(2)①氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
②相同温度下,溶度积大的物质向溶度积小的物质转化,所以Ksp(K2FeO4)<Ksp(Na2FeO4),故答案为:<;
(3)高铁酸钠具有强氧化性,所以能杀菌消毒,氢氧化铁胶体具有吸附性,所以能净水,故答案为:杀菌消毒、净水;
(4)①根据图象知,随着溶液酸性的增强,HFeO4-的分布分数先增大后减小,故答案为:先变大,后变小;
②根据图象知,随着溶液酸性的之间增强,FeO42-的分布分数逐渐增大,HFeO4-的分布分数逐渐减小,所以HFeO4-转化为FeO42-,故答案为:HFeO4-转化为FeO42-.
点评:本题考查原电池原理、难溶电解质的溶解平衡等知识点,难度不大,注意基础知识的积累、运用.

练习册系列答案
相关题目